Multímero
[1] De esta forma, un multímero es el nombre dado a una proteína que presenta estructura cuaternaria.
Muchas proteínas, especialmente aquellas con pesos moleculares elevados, presentan estructura cuaternaria, esto significa que están formadas por varias cadenas polipeptídicas (desde dos a centenares de ellas).
Un gran número de proteínas oligoméricas contienen dos o cuatro subunidades protoméricas, denominadas dímeros y tetrámetros respectivamente.
Las proteínas reguladoras impiden que se lleven a cabo reacciones metabólicas, por ejemplo, cuando estas no sean necesarias (por ejemplo, no se sintetizarán ácidos grasos a partir de glucosa cuando la célula requiera mucho aporte energético.
En otros casos, las diferentes subunidades de un mismo multímero pueden llevar a cabo funciones separadas aunque relacionadas, tales como la catálisis y la regulación.
Así esta proteína podrá autorregular la reacción que catalice, ahorrando espacio y aumentando la eficiencia celular.
Las letras griegas α y β no se refieren a estructuras secundarias.
Las interacciones que mantienen unidas estas subunidades son del mismo tipo que las descritas para los multímeros homotípicos: fuerzas no covalentes (excepto enlaces covalentes disulfuro) en las superficies proteicas complementarias.
Aunque son menos numerosos, los encruzamientos covalentes estabilizan significativamente determinadas proteínas con varias subunidades.
Los encruzamientos de desmosina conectan cuatro cadenas polipeptídicas en la proteína elastina del tejido conjuntivo, semejante a la goma.
Los cambios conformacionales inducidos por el ligando en esas proteínas se denominan transiciones alostéricas, y los ligandos que las desencadenan efectores o moduladores.
Aunque estos desaparecen una vez el ligando se desprende de la proteína, que vuelve a su forma inicial.
Por tanto, a nivel molecular es muy importante tener en cuenta la cinética enzimática para poder entender el funcionamiento de los seres vivos y su estructura.
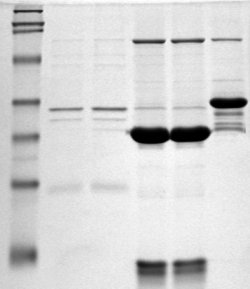
En estas condiciones, en presencia del SDS, la estructura secundaria, terciaria y cuaternaria de las proteínas se descomponen todas.
Estas partículas (proteínas cargadas negativamente por efecto del SDS) migrarán en la electroforesis en gel con movilidades relativas, que dependen únicamente de sus longitudes.
Para dejar claro que sólo está presente un tipo de cadena, se debe recurrir a otros métodos.
Por ejemplo, el enfoque isoeléctrico (asilando las subunidades sin detergentes o agentes cariotrópicos) puede ser una técnica muy sensible.
Las partículas con distinta relación masa/carga se separan mediante su deflexión en un campo magnético o bien midiendo simplemente su tiempo de vuelo hasta un detector.
Cada molécula recibe una carga determinada (normalmente sólo unas pocas unidades electrónicas, + o -) durante su ionización.
Esto significa que, cuanto mayor sea la molécula, se moverá más lentamente.