Diagrama de Davenport
Cuando se expone una muestra de sangre a la atmósfera, ya sea en el alveolo pulmonar o en un experimento in vitro, el dióxido de carbono (CO2) del aire se equilibra rápidamente con los derivados del CO2 y otras especies presentes en la solución acuosa.
Al combinarse con el agua (H2O), el CO2 forma el ácido carbónico (H2CO3), que rápidamente se disocia a bicarbonato (HCO3-) y protón de hidrógeno (H+).
Los protones liberados en esta ecuación pueden ser captados por bases (representada por B-), formando el ácido conjugado HB.
Dado que en la sangre humana se hallan varios buffers no-bicarbonato, el equilibrio final alcanzado a cualquier presión parcial de CO2 (pCO2) es altamente complejo y no puede predecirse fácilmente solo sobre la base de consideraciones teóricas.
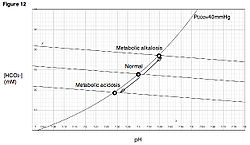
La figura 2 muestra un diagrama de Davenport tal como se suele representar en la literatura.
Ahora, imagine que se obtiene una muestra nueva e idéntica de sangre del mismo paciente.
Dado que el dióxido de carbono gaseoso se halla en equilibrio con los derivados del mismo en la solución (véase Fig.
7 puede pensarse como un mapa topográfica -esto es, una representación bidimensional de una superficie tridimensional- donde cada isobara indica una presión parcial o "altitud" diferente.
Las curvas azules oscuras muestras las ubicaciones reales de las isobaras en tres dimensiones.
Así, las líneas celestes solo son proyecciones a un plano bidimensional de las isobaras en el espacio tridimensional.
La superficie verde describe todas las combinaciones de PCO2, [HCO3-] y pH que satisfacen el equilibrio para el sistema.
(Más tarde se veras como pueden determinarse múltiples curvas de amortiguación paralelas para un sistema dado.)
Para entender como un cambio en la respiración puede afectar el pH sanguíneo, considérese los efectos de la ventilación pulmonar sobre la PCO2.
En el primer caso, dado que se acumula dióxido de carbono a nivel pulmonar, la PCO2 alveolar alcanzara valores muy altos.
Como indica el diagrama de Davenport, la depresión respiratoria, que resulta en una PCO2 alta, disminuirá el pH sanguíneo.
Un aumento del pH debido a hiperventilación se conoce como alcalosis respiratoria (Fig.
Sin embargo, si se varía la PCO2 sin añadir más ácido o base fuerte a la solución, puede determinarse una nueva curva de amortiguación que se encontrara sobre la curva de amortiguación original y será, aproximadamente, paralela a esta.
En forma alternativa, si se añaden protones al torrente sanguíneo en la forma de metabolitos ácidos, como ocurre durante la cetoacidosis diabética, el pH disminuirá así como la concentración de bicarbonato.