
En química , la volatilidad es una cualidad material que describe la facilidad con la que se vaporiza una sustancia . A una temperatura y presión determinadas , es más probable que una sustancia con alta volatilidad exista como vapor , mientras que es más probable que una sustancia con baja volatilidad sea líquida o sólida . La volatilidad también puede describir la tendencia de un vapor a condensarse en un líquido o sólido; Las sustancias menos volátiles se condensarán más fácilmente a partir de un vapor que las muy volátiles. [1] Las diferencias en la volatilidad se pueden observar comparando la rapidez con la que las sustancias dentro de un grupo se evaporan (o se subliman en el caso de los sólidos) cuando se exponen a la atmósfera. Una sustancia altamente volátil como el alcohol isopropílico se evaporará rápidamente, mientras que una sustancia con baja volatilidad como el aceite vegetal permanecerá condensada. [2] En general, los sólidos son mucho menos volátiles que los líquidos, pero existen algunas excepciones. Los sólidos que se subliman (cambian directamente de sólido a vapor), como el hielo seco ( dióxido de carbono sólido ) o el yodo , pueden vaporizarse a un ritmo similar al de algunos líquidos en condiciones estándar. [3]
La volatilidad en sí no tiene un valor numérico definido, pero a menudo se describe utilizando presiones de vapor o puntos de ebullición (para líquidos). Las presiones de vapor altas indican una volatilidad alta, mientras que los puntos de ebullición altos indican una volatilidad baja. Las presiones de vapor y los puntos de ebullición a menudo se presentan en tablas y gráficos que pueden usarse para comparar sustancias químicas de interés. Los datos de volatilidad generalmente se encuentran mediante experimentación en un rango de temperaturas y presiones.
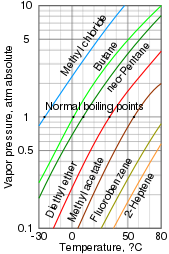
La presión de vapor es una medida de la facilidad con la que una fase condensada forma vapor a una temperatura determinada. Una sustancia encerrada en un recipiente sellado inicialmente al vacío (sin aire en el interior) llenará rápidamente cualquier espacio vacío con vapor. Una vez que el sistema alcanza el equilibrio y la tasa de evaporación coincide con la tasa de condensación, se puede medir la presión de vapor. Al aumentar la temperatura aumenta la cantidad de vapor que se forma y, por tanto, la presión de vapor. En una mezcla, cada sustancia contribuye a la presión de vapor general de la mezcla, y los compuestos más volátiles contribuyen en mayor medida.
El punto de ebullición es la temperatura a la que la presión de vapor de un líquido es igual a la presión circundante, lo que hace que el líquido se evapore o hierva rápidamente. Está estrechamente relacionado con la presión de vapor, pero depende de la presión. El punto de ebullición normal es el punto de ebullición a presión atmosférica, pero también se puede indicar a presiones más altas y más bajas. [3]

Un factor importante que influye en la volatilidad de una sustancia es la fuerza de las interacciones entre sus moléculas. Las fuerzas de atracción entre moléculas son las que mantienen unidos los materiales, y los materiales con fuerzas intermoleculares más fuertes , como la mayoría de los sólidos, no suelen ser muy volátiles. El etanol y el dimetil éter , dos sustancias químicas con la misma fórmula (C 2 H 6 O), tienen diferentes volatilidades debido a las diferentes interacciones que se producen entre sus moléculas en la fase líquida: las moléculas de etanol son capaces de formar enlaces de hidrógeno mientras que las moléculas de dimetil éter no. . [4] El resultado es una fuerza de atracción general más fuerte entre las moléculas de etanol, lo que la convierte en la sustancia menos volátil de las dos.
En general, la volatilidad tiende a disminuir al aumentar la masa molecular porque las moléculas más grandes pueden participar en más enlaces intermoleculares, [5] aunque otros factores como la estructura y la polaridad juegan un papel importante. El efecto de la masa molecular se puede aislar parcialmente comparando sustancias químicas de estructura similar (es decir, ésteres, alcanos, etc.). Por ejemplo, los alcanos lineales exhiben una volatilidad decreciente a medida que aumenta el número de carbonos en la cadena.

El conocimiento de la volatilidad suele ser útil para separar los componentes de una mezcla. Cuando una mezcla de sustancias condensadas contiene múltiples sustancias con diferentes niveles de volatilidad, su temperatura y presión se pueden manipular de modo que los componentes más volátiles se conviertan en vapor mientras que las sustancias menos volátiles permanecen en la fase líquida o sólida. El vapor recién formado puede entonces desecharse o condensarse en un recipiente aparte. Cuando se recogen los vapores, este proceso se conoce como destilación . [6]
El proceso de refinamiento del petróleo utiliza una técnica conocida como destilación fraccionada , que permite separar en un solo paso varias sustancias químicas de diferente volatilidad. El petróleo crudo que ingresa a una refinería está compuesto de muchas sustancias químicas útiles que deben separarse. El petróleo crudo fluye hacia una torre de destilación y se calienta, lo que permite que los componentes más volátiles, como el butano y el queroseno , se vaporicen. Estos vapores ascienden por la torre y eventualmente entran en contacto con superficies frías, lo que hace que se condensen y se recojan. Los químicos más volátiles se condensan en la parte superior de la columna, mientras que los químicos menos volátiles para vaporizarse se condensan en la porción más baja. [1] A la derecha hay una imagen que ilustra el diseño de una torre de destilación .
La diferencia de volatilidad entre el agua y el etanol se ha utilizado tradicionalmente para refinar el consumo de alcohol . Para aumentar la concentración de etanol en el producto, los fabricantes de alcohol calentarían la mezcla inicial de alcohol a una temperatura en la que la mayor parte del etanol se vaporiza mientras que la mayor parte del agua permanece líquida. Luego, el vapor de etanol se recoge y se condensa en un recipiente aparte, lo que da como resultado un producto mucho más concentrado. [7]
La volatilidad es una consideración importante a la hora de elaborar perfumes . Los humanos detectan olores cuando los vapores aromáticos entran en contacto con los receptores de la nariz. Los ingredientes que se vaporizan rápidamente después de ser aplicados producirán vapores fragantes por un corto tiempo antes de que los aceites se evaporen. Los ingredientes de evaporación lenta pueden permanecer en la piel durante semanas o incluso meses, pero es posible que no produzcan suficientes vapores para producir un aroma fuerte. Para prevenir estos problemas, los diseñadores de perfumes consideran cuidadosamente la volatilidad de los aceites esenciales y otros ingredientes de sus perfumes. Se logran tasas de evaporación adecuadas modificando la cantidad de ingredientes altamente volátiles y no volátiles utilizados. [8]