Estados Unidos realiza el 46% de la investigación y el desarrollo (I+D) mundial en ciencias de la vida, lo que lo convierte en el líder mundial en investigación médica . [1]
Las ciencias de la vida representaron el 51% del gasto federal en investigación en 2011. [1]
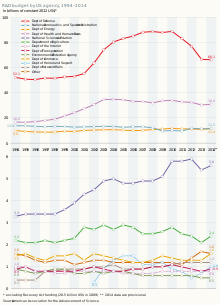
Los Institutos Nacionales de Salud (NIH) se consideran la principal organización gubernamental de financiación de la investigación biomédica. Entre 2004 y 2014, la financiación de los NIH se mantuvo relativamente estable y no aumentó para seguir el ritmo de la inflación . El presupuesto de los NIH alcanzó un máximo de aproximadamente 35 mil millones de dólares por año entre 2003 y 2005 y fue de alrededor de 30 mil millones de dólares en 2015. [1]
Los esfuerzos del gobierno por aumentar las asignaciones a la investigación entre 2013 y 2016 se vieron frustrados a menudo por la campaña de austeridad del Congreso, que retuvo varias veces la aprobación del presupuesto del gobierno federal. Durante este período, las prioridades del ejecutivo se impulsaron en gran medida gracias a la colaboración entre el gobierno, la industria y el sector sin fines de lucro. Esto fue particularmente cierto en el caso del sector de la salud que, al igual que el cambio climático, fue una prioridad para la administración Obama . [1]
Un objetivo clave de la administración Obama fue desarrollar terapias más específicas y, al mismo tiempo, reducir el tiempo y el costo del desarrollo de medicamentos. El desarrollo de un nuevo medicamento lleva más de una década y tiene una tasa de fracaso de más del 95%. Los fracasos más costosos ocurren en las últimas fases de los ensayos clínicos. Por lo tanto, es vital identificar los objetivos biológicos correctos (genes, proteínas y otras moléculas) en las primeras etapas del proceso, a fin de diseñar medicamentos más racionales y terapias mejor adaptadas. [1]
La Ley de Curas del Siglo XXI se promulgó el 13 de diciembre de 2016, un año después de la publicación del Informe de la UNESCO sobre la Ciencia . El informe había pronosticado que: [1]
Si el proyecto de ley se aprueba, modificará la forma en que se llevan a cabo los ensayos clínicos, al permitir diseños de ensayos nuevos y adaptativos que tengan en cuenta parámetros personalizados, como biomarcadores y genética. Esta disposición ha resultado controvertida, y los médicos advierten que depender demasiado de los biomarcadores como medida de eficacia puede ser engañoso, ya que es posible que no siempre reflejen mejores resultados para los pacientes.
Otro plan gubernamental espera aumentar el número de nuevos diagnósticos y terapias para los pacientes, al tiempo que reduce el tiempo y el costo de su desarrollo. En el lanzamiento de la Asociación para Acelerar los Medicamentos en febrero de 2014, el director del NIH, Francis S. Collins, afirmó que "actualmente, estamos invirtiendo demasiado dinero y tiempo en vías que no dan resultado, mientras los pacientes y sus familias esperan". Durante los cinco años hasta 2019, esta asociación público-privada está desarrollando hasta cinco proyectos piloto para tres enfermedades comunes pero difíciles de tratar: la enfermedad de Alzheimer, la diabetes tipo 2 (de inicio en la edad adulta) y los trastornos autoinmunes de la artritis reumatoide y el lupus. [1]

En la alianza participan los Institutos Nacionales de Salud (NIH) y la Administración de Alimentos y Medicamentos (FDA), así como 10 importantes compañías biofarmacéuticas y varias organizaciones sin fines de lucro como la Asociación del Alzheimer. Los socios industriales son Abbvie (EE. UU.), Biogen (EE. UU.), Bristol Myers Squibb (EE. UU.), GlaxoSmithKline (Reino Unido), Johnson & Johnson (EE. UU.), Lilly (EE. UU.), Merck (EE. UU.), Pfizer (EE. UU.), Sanofi (Francia) y Takeda (Japón). [1]
Los laboratorios comparten muestras, como sangre o tejido cerebral de pacientes fallecidos, para identificar biomarcadores. También participan en ensayos clínicos de los NIH. Un componente fundamental es que los socios de la industria han acordado poner los datos y análisis resultantes de la asociación a disposición de la amplia comunidad biomédica. No utilizarán ningún descubrimiento para desarrollar su propio fármaco hasta que estos hallazgos se hayan hecho públicos. [1]
En abril de 2013, el gobierno anunció otra asociación público-privada, esta vez para implementar su Iniciativa de Investigación del Cerebro a través del Fomento de Neurotecnologías Innovadoras (BRAIN, por sus siglas en inglés). El objetivo de este proyecto es aprovechar las tecnologías genéticas, ópticas y de imágenes para mapear neuronas individuales y circuitos complejos en el cerebro, lo que eventualmente conducirá a una comprensión más completa de la estructura y función de este órgano. Para 2015, la Iniciativa BRAIN había "obtenido compromisos de más de US$ 300 millones en recursos de agencias federales ( Institutos Nacionales de Salud , Administración de Alimentos y Medicamentos , Fundación Nacional de Ciencias, etc.), la industria (Iniciativa Nacional de Fotónica, General Electric , Google , GlaxoSmithKline, etc.) y filantropía (fundaciones y universidades)". [1]
La Iniciativa de Medicina de Precisión ha sido otra prioridad del gobierno. Definida como la entrega del tratamiento correcto al paciente correcto en el momento correcto, la medicina de precisión adapta los tratamientos a los pacientes en función de su fisiología, bioquímica y genética únicas. En su solicitud de presupuesto para 2016, el presidente pidió 215 millones de dólares para ser compartidos por el NIH, el Instituto Nacional del Cáncer y la FDA para financiar la Iniciativa de Medicina de Precisión. [1]
En 2013, las compañías farmacéuticas estadounidenses gastaron 40.000 millones de dólares en I+D dentro del país y casi otros 11.000 millones de dólares en I+D en el extranjero. [1]
Entre 2005 y 2010, las compañías farmacéuticas y biofarmacéuticas aumentaron su inversión en medicina de precisión en aproximadamente un 75% y se proyecta un aumento adicional del 53% para 2015. Entre el 12% y el 50% de los productos en sus líneas de desarrollo de fármacos están relacionados con la medicina personalizada. [1]
El gobierno federal y la mayoría de los 50 estados que conforman Estados Unidos ofrecen créditos fiscales para I+D a determinadas industrias y empresas. El Congreso suele renovar los créditos fiscales cada pocos años. Según una encuesta realizada por el Wall Street Journal en 2012, las empresas no tienen en cuenta estos créditos a la hora de tomar decisiones sobre inversiones en I+D, ya que no pueden confiar en que se renueven. [2]
En 2014, seis empresas biofarmacéuticas estadounidenses figuraron en el Top 50 mundial por volumen de gasto en I+D. Las siguientes figuran en el Top 20 desde hace al menos diez años: Intel, Microsoft, Johnson & Johnson, Pfizer e IBM. Google fue incluida por primera vez en 2013 y Amazon en 2014, por lo que la tienda online no figura en el Top 50 de 2014. [1]
Las 50 principales empresas mundiales por volumen e intensidad de I+D, 2014
*La intensidad de I+D se define como el gasto en I+D dividido por las ventas netas.
** Aunque está constituida en los Países Bajos, las principales instalaciones de fabricación de Airbus están ubicadas en Francia, Alemania, España y el Reino Unido.
Fuente: Informe de la UNESCO sobre la ciencia: hacia 2030 (2015), Tabla 9.3, basado en Hernández et al. (2014) EU R&D Scoreboard: the 2014 EU Industrial R&D Investment Scoreboard . Comisión Europea : Bruselas, Tabla 2.2.
La Asociación Nacional de Capital de Riesgo ha informado de que, en 2014, la inversión de capital de riesgo en las ciencias de la vida alcanzó su nivel más alto desde 2008: en biotecnología, se invirtieron 6.000 millones de dólares en 470 operaciones y, en las ciencias de la vida en general, 8.600 millones de dólares en 789 operaciones (incluidas las de biotecnología y dispositivos médicos). Dos tercios (68%) de la inversión en biotecnología se destinó a operaciones de desarrollo iniciales y el resto a la fase de expansión del desarrollo (14%), a empresas en fase inicial (11%) y a empresas en fase avanzada (7%). [1]
Sin embargo, fue la industria del software la que invirtió en el mayor número de operaciones en total: 1.799, por una inversión de 19.800 millones de dólares. En segundo lugar se situaron las empresas específicas de Internet, que obtuvieron 11.900 millones de dólares en inversiones a través de 1.005 operaciones. Muchas de estas empresas tienen su sede en el estado de California, que por sí solo concentra el 28% de la investigación estadounidense. [1]
La inversión total en capital de riesgo ascendió en 2014 a 48.300 millones de dólares, en 4.356 operaciones, lo que representó "un aumento del 61% en dólares y un 4% en operaciones respecto al año anterior", según informó la Asociación Nacional de Capital de Riesgo. [1]
La Organización para la Cooperación y el Desarrollo Económicos estima que la inversión de capital de riesgo en los Estados Unidos se había recuperado completamente en 2014. [3]
En los últimos años, varias compañías farmacéuticas han realizado fusiones estratégicas para trasladar sus sedes al extranjero y obtener ventajas fiscales, entre ellas Medtronic y Endo International. El propio intento de Pfizer de adquirir la compañía farmacéutica británica AstraZeneca fracasó en 2014 después de que Pfizer admitiera sus planes de recortar el gasto en investigación en la empresa fusionada. [1]
Una de las preocupaciones de política de la administración Obama ha sido el pronunciado aumento del precio de los medicamentos recetados , en un país donde estos precios están en gran medida desregulados. Entre enero de 2008 y diciembre de 2014, el precio de los medicamentos de marca de uso común aumentó un poco más del 127%, mientras que el precio de los medicamentos genéricos de prescripción habitual disminuyó casi un 63%. [1]
En 2014, el gasto en medicamentos recetados alcanzó los 374.000 millones de dólares. Este aumento del gasto se debió a los nuevos y costosos medicamentos que se comercializaron para tratar la hepatitis C (11.000 millones de dólares), en lugar de a los millones de estadounidenses recién asegurados en virtud de la Ley de Protección al Paciente y Atención Médica Asequible de 2010 (1.000 millones de dólares). "Alrededor del 31% de este gasto se destinó a terapias farmacológicas especializadas para tratar enfermedades inflamatorias, esclerosis múltiple, oncología, hepatitis C y VIH, etc., y el 6,4% a terapias tradicionales para tratar la diabetes, el colesterol alto, el dolor, la hipertensión arterial y las enfermedades cardíacas, el asma, la depresión, etc." [1]
El aumento "astronómico" de los precios de los medicamentos recetados ha sido impulsado por una nueva tendencia en los EE. UU.: la adquisición de productos farmacéuticos mediante licencias, compras, fusiones o adquisiciones. En la primera mitad de 2014, el valor de las fusiones y adquisiciones de las compañías farmacéuticas ascendió a 317.400 millones de dólares y, en el primer trimestre de 2015, la industria farmacéutica representó un poco más del 45% de todas las fusiones y adquisiciones de los EE. UU. Varias compañías farmacéuticas han realizado fusiones estratégicas en los últimos años para trasladar sus sedes centrales al extranjero con el fin de obtener una ventaja fiscal. El propio intento de Pfizer de adquirir la compañía farmacéutica británica AstraZeneca fracasó en 2014, después de que Pfizer admitiera planes de recortar el gasto en investigación en la empresa fusionada. [1]
La Ley de Innovación y Competencia de Precios de Productos Biológicos se promulgó en marzo de 2010 para fomentar el desarrollo de la competencia de medicamentos genéricos como medida de contención de costos para los productos farmacéuticos de alto precio. Como parte de la Ley de Protección al Paciente y Atención Médica Asequible firmada por el gobierno , ha creado una vía para la concesión de licencias por vía rápida para productos biológicos que se demuestre que son "biosimilares" a, o "intercambiables" con, un producto biológico aprobado. Una inspiración para la ley fue que las patentes de muchos medicamentos biológicos expirarán en la próxima década. [1]
Aunque la ley se aprobó en 2010, el primer biosimilar fue aprobado en los EE. UU. por la FDA recién en 2015: Zarxio, fabricado por Sandoz . Zarxio es un biosimilar del medicamento contra el cáncer Neupogen, que aumenta los glóbulos blancos del paciente para prevenir infecciones. En septiembre de 2015, un tribunal estadounidense dictaminó que el fabricante de la marca Neupogen, Amgen, no podía bloquear la venta de Zarxio en los EE. UU. Neupogen cuesta alrededor de US$3000 por ciclo de quimioterapia; Zarxio llegó al mercado estadounidense el 3 de septiembre de 2015 con un descuento del 15 %. [1]
En Europa, el mismo fármaco había sido aprobado ya en 2008 y desde entonces se comercializa sin problemas. El retraso en el desarrollo de un proceso de aprobación en los Estados Unidos ha sido criticado por obstaculizar el acceso a las terapias biológicas. [1]
Es difícil evaluar el verdadero ahorro de costos que se generaría con el uso de biosimilares. Un estudio de 2014 del Instituto Rand estima un ahorro de entre 13.000 y 66.000 millones de dólares durante el período 2014-2024, dependiendo del nivel de competencia y de los patrones de aprobación regulatoria de la FDA. [1]
A diferencia de los genéricos, los biosimilares no pueden aprobarse sobre la base de pruebas mínimas y económicas para demostrar la bioequivalencia. Dado que los medicamentos biológicos son productos complejos y heterogéneos derivados de células vivas, solo se puede demostrar que son muy similares al producto de referencia adecuado y, por lo tanto, es necesario demostrar que no existen diferencias clínicamente significativas en cuanto a seguridad y eficacia. La medida en que se requieran ensayos clínicos determinará en gran medida el costo del desarrollo. [1]
Las enfermedades huérfanas afectan a menos de 200.000 estadounidenses cada año. Desde la Ley de Medicamentos Huérfanos de 1983, la Administración de Alimentos y Medicamentos ha designado más de 400 medicamentos y productos biológicos para enfermedades raras (hasta 2015), 260 solo en 2013. En 2014, las ventas de los 10 principales medicamentos huérfanos en los EE. UU. ascendieron a 18.320 millones de dólares; para 2020, se proyecta que las ventas de medicamentos huérfanos en todo el mundo representen el 19% (28.160 millones de dólares) del total de 176.000 millones de dólares en gastos de medicamentos recetados. [1]
Sin embargo, en 2014, los medicamentos huérfanos costaron aproximadamente 19,1 veces más que los medicamentos no huérfanos (sobre una base anual), con un costo anual promedio por paciente de US$137.782. A algunos les preocupa que los incentivos que ofrece el programa de medicamentos huérfanos de la FDA a las compañías farmacéuticas para desarrollar medicamentos huérfanos estén desviando la atención de las compañías hacia el desarrollo de medicamentos que beneficiarán a una mayor parte de la población. [1]
En Estados Unidos existen más de 6500 empresas de dispositivos médicos, de las cuales más del 80% tienen menos de 50 empleados. Según el Departamento de Comercio de Estados Unidos , se espera que el tamaño del mercado de la industria de dispositivos médicos en Estados Unidos alcance los 133 mil millones de dólares estadounidenses en 2016. [1]
Los observadores prevén un mayor desarrollo y surgimiento de dispositivos portátiles de monitoreo de la salud, telediagnóstico y telemonitorización, robótica, biosensores, impresión tridimensional (3D), nuevas pruebas de diagnóstico in vitro y aplicaciones móviles que permitan a los usuarios monitorear mejor su salud y comportamiento relacionado. [1]
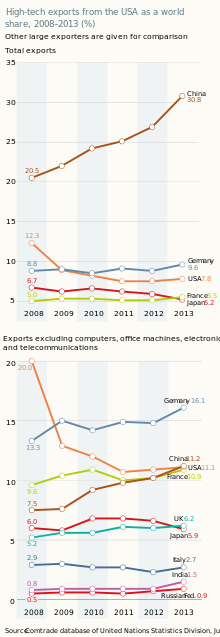
Hasta 2010, Estados Unidos era un exportador neto de productos farmacéuticos. Desde 2011, se ha convertido en un importador neto de esos bienes. Estados Unidos ha perdido su liderazgo mundial en materia de productos de alta tecnología. Hasta los equipos informáticos y de comunicaciones se ensamblan ahora en China y otras economías emergentes, y los componentes de alta tecnología con valor añadido se producen en otros lugares. [1]
Estados Unidos es un país postindustrial. Las importaciones de productos de alta tecnología superan con creces las exportaciones. Sin embargo, la fuerza laboral tecnológicamente capacitada de Estados Unidos produce un gran volumen de patentes y aún puede obtener ganancias de la concesión de licencias o la venta de esas patentes. Dentro de las industrias científicas de Estados Unidos activas en la investigación, el 9,1% de los productos y servicios están relacionados con la concesión de licencias de derechos de propiedad intelectual. [1]
En materia de comercio de propiedad intelectual, Estados Unidos sigue sin rival. Los ingresos por regalías y licencias ascendieron a 129.200 millones de dólares en 2013, el nivel más alto del mundo. Japón ocupa un distante segundo lugar, con ingresos por 31.600 millones de dólares en 2013. Los pagos de Estados Unidos por el uso de propiedad intelectual ascendieron a 39.000 millones de dólares en 2013, superados sólo por Irlanda (46.400 millones de dólares). [1]
![]() Este artículo incorpora texto de una obra de contenido libre . Licencia CC-BY-SA IGO 3.0. Texto extraído del Informe de la UNESCO sobre la Ciencia: hacia 2030, UNESCO.
Este artículo incorpora texto de una obra de contenido libre . Licencia CC-BY-SA IGO 3.0. Texto extraído del Informe de la UNESCO sobre la Ciencia: hacia 2030, UNESCO.