Un clatrato es una sustancia química que consiste en una red que atrapa o contiene moléculas. La palabra clatrato se deriva del latín clathratus ( clatratus ), que significa 'con barras, enrejado '. [1] La mayoría de los compuestos de clatrato son poliméricos y envuelven completamente a la molécula huésped, pero en el uso moderno los clatratos también incluyen complejos huésped-anfitrión y compuestos de inclusión . [2] Según la IUPAC , los clatratos son compuestos de inclusión "en los que la molécula huésped está en una jaula formada por la molécula huésped o por una red de moléculas huésped". [3] El término se refiere a muchos huéspedes moleculares, incluidos los calixarenos y las ciclodextrinas e incluso algunos polímeros inorgánicos como las zeolitas .
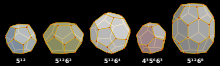
Los clatratos se pueden dividir en dos categorías: hidratos de clatrato y clatratos inorgánicos. Cada clatrato está formado por un armazón y huéspedes que residen en el armazón. Las estructuras cristalinas de clatrato más comunes pueden estar compuestas por cavidades como cavidades dodecaédricas , tetracaidecaédricas y hexacaidecaédricas . A diferencia de los hidratos, los clatratos inorgánicos tienen un armazón de átomos inorgánicos unidos covalentemente con huéspedes que normalmente consisten en metales alcalinos o alcalinotérreos . Debido al enlace covalente más fuerte, las jaulas suelen ser más pequeñas que los hidratos. Los átomos huéspedes interactúan con el anfitrión mediante enlaces iónicos o covalentes. Por lo tanto, la sustitución parcial de átomos huéspedes sigue las reglas de Zintl para que se conserve la carga del compuesto general. La mayoría de los clatratos inorgánicos tienen una ocupación completa de sus jaulas de armazón por un átomo huésped para estar en fase estable. Los clatratos inorgánicos se pueden sintetizar por reacción directa utilizando molienda de bolas a altas temperaturas o altas presiones. La cristalización a partir de material fundido es otra vía de síntesis habitual. Debido a la amplia variedad de composición de las especies huésped y anfitriona, los clatratos inorgánicos son mucho más diversos químicamente y poseen una amplia gama de propiedades. En particular, se puede observar que los clatratos inorgánicos son tanto aislantes como superconductores (Ba 8 Si 46 ). Una propiedad común de los clatratos inorgánicos que ha atraído a los investigadores es la baja conductividad térmica . La baja conductividad térmica se atribuye a la capacidad del átomo huésped de "traquetear" dentro de la estructura del anfitrión. La libertad de movimiento de los átomos huéspedes dispersa los fonones que transportan calor. [4]


Los clatratos se han explorado para muchas aplicaciones, entre ellas: almacenamiento de gas, producción de gas, separación de gas, desalinización , termoelectricidad , energía fotovoltaica y baterías.
2CCl4.jpg/440px-Cd(CN)2CCl4.jpg)
