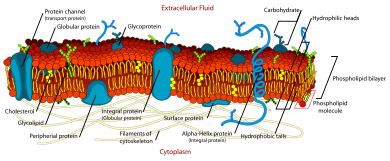
El modelo de mosaico fluido explica diversas características respecto a la estructura de las membranas celulares funcionales . Según este modelo biológico , existe una bicapa lipídica (capa de dos moléculas de espesor formada principalmente por fosfolípidos anfipáticos ) en la que se incrustan moléculas de proteínas . La bicapa de fosfolípidos aporta fluidez y elasticidad a la membrana . También se encuentran pequeñas cantidades de carbohidratos en la membrana celular. El modelo biológico, ideado por Seymour Jonathan Singer y Garth L. Nicolson en 1972, [1] describe la membrana celular como un líquido bidimensional que restringe la difusión lateral de los componentes de la membrana. Dichos dominios se definen por la existencia de regiones dentro de la membrana con un capullo especial de lípidos y proteínas que promueven la formación de balsas lipídicas o complejos de proteínas y glicoproteínas . Otra forma de definir los dominios de membrana es la asociación de la membrana lipídica con los filamentos del citoesqueleto y la matriz extracelular a través de proteínas de membrana. [2] El modelo actual describe características importantes relevantes para muchos procesos celulares, que incluyen: señalización célula-célula , apoptosis , división celular , gemación de membranas y fusión celular. El modelo de mosaico fluido es el modelo más aceptable de membrana plasmática. En esta definición de membrana celular, su función principal es actuar como barrera entre el contenido del interior de la célula y el entorno extracelular.
La propiedad fluida de las membranas biológicas funcionales se determinó mediante experimentos de etiquetado , difracción de rayos X y calorimetría. Estos estudios demostraron que las proteínas integrales de la membrana se difunden a velocidades afectadas por la viscosidad de la bicapa lipídica en la que estaban incrustadas, y demostraron que las moléculas dentro de la membrana celular son dinámicas en lugar de estáticas. [1]
Los modelos anteriores de membranas biológicas incluían el modelo de membrana unitaria de Robertson y el modelo de tres capas de Davson-Danielli . [2] Estos modelos tenían proteínas presentes como láminas vecinas a una capa lipídica, en lugar de incorporadas a la bicapa de fosfolípidos. Otros modelos describían unidades regulares y repetidas de proteínas y lípidos. Estos modelos no estaban bien respaldados por datos microscópicos y termodinámicos , y no incluían evidencia de las propiedades dinámicas de la membrana. [2]

Frye y Edidin realizaron un experimento importante que proporcionó evidencia que respalda la biología dinámica y fluida. Utilizaron el virus Sendai para obligar a las células humanas y de ratón a fusionarse y formar un heterocarión . Utilizando tinción con anticuerpos , pudieron demostrar que las proteínas humanas y de ratón permanecían segregadas en mitades separadas del heterocarión poco tiempo después de la fusión celular. Sin embargo, las proteínas finalmente se difundieron y con el tiempo se perdió el límite entre las dos mitades. La reducción de la temperatura ralentizó la velocidad de esta difusión al hacer que los fosfolípidos de la membrana pasaran de una fase fluida a una fase de gel. [3] Singer y Nicolson racionalizaron los resultados de estos experimentos utilizando su modelo de mosaico fluido. [1]
El modelo de mosaico fluido explica los cambios en la estructura y el comportamiento de las membranas celulares bajo diferentes temperaturas, así como la asociación de proteínas de membrana con las membranas. Si bien Singer y Nicolson obtuvieron evidencia sustancial extraída de múltiples subcampos para respaldar su modelo, los avances recientes en microscopía de fluorescencia y biología estructural han validado la naturaleza de mosaico fluido de las membranas celulares.
Además, las dos valvas de las membranas biológicas son asimétricas y están divididas en subdominios compuestos de proteínas o lípidos específicos, lo que permite la segregación espacial de los procesos biológicos asociados con las membranas. El colesterol y las proteínas que interactúan con el colesterol pueden concentrarse en balsas lipídicas y limitar los procesos de señalización celular únicamente a estas balsas. [4] Otra forma de asimetría fue mostrada por el trabajo de Mouritsen y Bloom en 1984, donde propusieron un modelo de colchón de interacciones lípido-proteína para abordar la evidencia biofísica de que la membrana puede variar en espesor e hidrofobicidad de las proteínas. [5]
La existencia de formaciones lipídicas no bicapa con importantes funciones biológicas se confirmó tras la publicación del modelo de mosaico fluido. Estas estructuras de membrana pueden ser útiles cuando la célula necesita propagarse en una forma no bicapa, lo que ocurre durante la división celular y la formación de una unión gap . [6]
La bicapa de membrana no siempre es plana. La curvatura local de la membrana puede ser causada por la asimetría y la organización no bicapa de los lípidos como se analizó anteriormente. Se logra una curvatura más dramática y funcional a través de dominios BAR , que se unen al fosfatidilinositol en la superficie de la membrana, ayudando en la formación de vesículas , formación de orgánulos y división celular. [7] El desarrollo de la curvatura está en constante cambio y contribuye a la naturaleza dinámica de las membranas biológicas. [8]
Durante la década de 1970, se reconoció que las moléculas lipídicas individuales experimentan difusión lateral libre dentro de cada una de las capas de la membrana lipídica. [9] La difusión se produce a alta velocidad, con una molécula de lípido promedio difundiendo ~2 μm, aproximadamente la longitud de una célula bacteriana grande , en aproximadamente 1 segundo. [9] También se ha observado que las moléculas de lípidos individuales giran rápidamente alrededor de su propio eje. [9] Además, las moléculas de fosfolípidos pueden, aunque rara vez lo hacen, migrar de un lado de la bicapa lipídica al otro (un proceso conocido como flip-flop). Sin embargo, el movimiento flip-flop se ve reforzado por las enzimas flippasa. [10] Los procesos descritos anteriormente influyen en la naturaleza desordenada de las moléculas lipídicas y las proteínas que interactúan en las membranas lipídicas, con consecuencias para la fluidez, la señalización, el tráfico y la función de la membrana.
Existen restricciones a la movilidad lateral de los componentes lipídicos y proteicos en la membrana líquida impuestas por la formación de subdominios dentro de la bicapa lipídica. Estos subdominios surgen mediante varios procesos , por ejemplo, la unión de componentes de la membrana a la matriz extracelular, regiones nanométricas de la membrana con una composición bioquímica particular que promueven la formación de balsas lipídicas y complejos proteicos mediados por interacciones proteína-proteína. [2] Además, las asociaciones proteína-citoesqueleto median la formación de “cercas citoesqueléticas”, corrales donde los lípidos y las proteínas de la membrana pueden difundirse libremente, pero que rara vez pueden salir. [2] La restricción de las velocidades de difusión lateral de los componentes de la membrana es muy importante porque permite la especialización funcional de regiones particulares dentro de las membranas celulares.
Las balsas lipídicas son plataformas nanométricas de membrana con una composición particular de lípidos y proteínas que se difunden lateralmente, navegando sobre la capa bilípida líquida. Los esfingolípidos y el colesterol son componentes importantes de las balsas lipídicas. [11]
Las proteínas y glicoproteínas de la membrana celular no existen como elementos individuales de la membrana lipídica, como propusieron por primera vez Singer y Nicolson en 1972. Más bien, se presentan como complejos que se difunden dentro de la membrana. [2] El ensamblaje de moléculas individuales en estos complejos macromoleculares tiene importantes consecuencias funcionales para la célula; como el transporte de iones y metabolitos , la señalización, la adhesión celular y la migración . [2]
Algunas proteínas incrustadas en la capa bilípida interactúan con la matriz extracelular fuera de la célula, los filamentos del citoesqueleto dentro de la célula y las estructuras en forma de anillo de septina. Estas interacciones tienen una fuerte influencia en la forma y estructura, así como en la compartimentación . Además, imponen restricciones físicas que restringen la libre difusión lateral de proteínas y al menos algunos lípidos dentro de la capa bilipídica. [2]
Cuando las proteínas integrales de la bicapa lipídica están unidas a la matriz extracelular, no pueden difundirse libremente. Las proteínas con un dominio intracelular largo pueden chocar con una barrera formada por filamentos del citoesqueleto. [12] Ambos procesos restringen la difusión de proteínas y lípidos directamente involucrados, así como de otros componentes de las membranas celulares que interactúan.

Las septinas son una familia de proteínas de unión a GTP altamente conservadas entre los eucariotas. Los procariotas tienen proteínas similares llamadas paraseptinas. Forman estructuras compartimentadas en forma de anillos fuertemente asociadas con las membranas celulares. Los septinos participan en la formación de estructuras como cilios y flagelos, espinas dendríticas y yemas de levadura. [13]