La expresión génica espaciotemporal es la activación de genes dentro de tejidos específicos de un organismo en momentos específicos durante el desarrollo . Los patrones de activación génica varían ampliamente en complejidad. Algunos son sencillos y estáticos, como el patrón de la tubulina, que se expresa en todas las células en todo momento de la vida. Algunos, por otro lado, son extraordinariamente intrincados y difíciles de predecir y modelar, con una expresión que fluctúa enormemente de un minuto a otro o de una célula a otra. La variación espaciotemporal desempeña un papel clave en la generación de la diversidad de tipos de células que se encuentran en los organismos desarrollados; dado que la identidad de una célula está especificada por el conjunto de genes expresados activamente dentro de esa célula, si la expresión génica fuera uniforme espacial y temporalmente, podría haber como máximo un tipo de célula.
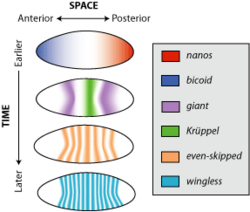
Consideremos el gen wingless, un miembro de la familia de genes wnt . En el desarrollo embrionario temprano del organismo modelo Drosophila melanogaster , o mosca de la fruta, wingless se expresa en casi todo el embrión en franjas alternas separadas por tres células. Este patrón se pierde cuando el organismo se convierte en larva, pero wingless todavía se expresa en una variedad de tejidos, como los discos imaginales del ala , parches de tejido que se convertirán en las alas adultas. El patrón espaciotemporal de la expresión del gen wingless está determinado por una red de interacciones reguladoras que consisten en los efectos de muchos genes diferentes, como even-skipped y Krüppel.
¿Qué causa las diferencias espaciales y temporales en la expresión de un único gen? Debido a que los patrones de expresión actuales dependen estrictamente de los patrones de expresión anteriores, existe un problema regresivo para explicar qué causó las primeras diferencias en la expresión génica. El proceso por el cual la expresión génica uniforme se vuelve espacial y temporalmente diferencial se conoce como ruptura de la simetría . Por ejemplo, en el caso del desarrollo embrionario de Drosophila , los genes nanos y bicoid se expresan asimétricamente en el ovocito porque las células maternas depositan ARN mensajero (ARNm) para estos genes en los polos del óvulo antes de su puesta .

Una forma de identificar el patrón de expresión de un gen en particular es colocar un gen reportero aguas abajo de su promotor. En esta configuración, el gen promotor hará que el gen reportero se exprese solo donde y cuando se expresa el gen de interés. La distribución de expresión del gen reportero se puede determinar visualizándolo. Por ejemplo, la proteína fluorescente verde del gen reportero se puede visualizar estimulándola con luz azul y luego utilizando una cámara digital para registrar la emisión fluorescente verde .
Si se desconoce el promotor del gen de interés, existen varias formas de identificar su distribución espaciotemporal. La inmunohistoquímica implica la preparación de un anticuerpo con afinidad específica por la proteína asociada al gen de interés. Esta distribución de este anticuerpo puede visualizarse luego mediante una técnica como el marcaje fluorescente. La inmunohistoquímica tiene las ventajas de ser metodológicamente factible y relativamente económica. Sus desventajas incluyen la no especificidad del anticuerpo que conduce a la identificación de expresión de falsos positivos . La baja penetración del anticuerpo en el tejido diana puede conducir a resultados falsos negativos . Además, dado que la inmunohistoquímica visualiza la proteína generada por el gen, si el producto proteico se difunde entre las células, o tiene una vida media particularmente corta o larga en relación con el ARNm que se utiliza para traducir la proteína, esto puede conducir a una interpretación distorsionada de qué células están expresando el ARNm .

La hibridación in situ es un método alternativo en el que se añade al tejido una "sonda", un ácido nucleico sintético con una secuencia complementaria al ARNm del gen. A continuación, se etiqueta químicamente esta sonda para que pueda visualizarse más tarde. Esta técnica permite la visualización específica de células productoras de ARNm sin ninguno de los artefactos asociados con la inmunohistoquímica. Sin embargo, es notoriamente difícil y requiere el conocimiento de la secuencia de ADN correspondiente al gen de interés.
Un método llamado cribado con trampas potenciadoras revela la diversidad de patrones de expresión génica espaciotemporal posibles en un organismo. En esta técnica, el ADN que codifica un gen reportero se inserta aleatoriamente en el genoma. Dependiendo de los promotores génicos próximos al punto de inserción, el gen reportero se expresará en tejidos particulares en puntos particulares del desarrollo. Si bien los patrones de expresión derivados de trampas potenciadoras no necesariamente reflejan los patrones reales de expresión de genes específicos, revelan la variedad de patrones espaciotemporales que son accesibles a la evolución.
Los genes reporteros se pueden visualizar en organismos vivos, pero tanto la inmunohistoquímica como la hibridación in situ deben realizarse en tejidos fijados . Las técnicas que requieren la fijación de tejido solo pueden generar un único punto temporal por organismo individual. Sin embargo, el uso de animales vivos en lugar de tejido fijado puede ser crucial para comprender dinámicamente los patrones de expresión a lo largo de la vida de un individuo. De cualquier manera, la variación entre individuos puede confundir la interpretación de los patrones de expresión temporal.
Se están buscando varios métodos para controlar la expresión génica espacialmente, temporalmente y en diferentes grados. Un método es mediante el uso de un sistema inductor/represor de operones que proporciona un control temporal de la expresión génica. Para controlar la expresión génica espacialmente, se están desarrollando impresoras de inyección de tinta para imprimir ligandos en cultivos de gel. [1] Otro método popular implica el uso de luz para controlar la expresión génica de manera espaciotemporal. Dado que la luz también se puede controlar fácilmente en el espacio, el tiempo y el grado, se han desarrollado y están en estudio varios métodos de control de la expresión génica a nivel de ADN y ARN [2] . Por ejemplo, la interferencia de ARN se puede controlar utilizando luz [3] [4] y también se ha realizado la modelización de la expresión génica en monocapas celulares [5] y en embriones de pez cebra utilizando morfolino enjaulado [6] o ácido nucleico peptídico [7] [8] [9] demostrando el control de la expresión génica espaciotemporalmente. Recientemente, se ha demostrado un control basado en la luz a nivel de ADN utilizando un sistema basado en transgenes [10] u oligos formadores de triplex enjaulados [11].