Las septinas son un grupo de proteínas de unión a GTP expresadas en todas las células eucariotas excepto en las plantas . [1] [2] [3] Las diferentes septinas forman complejos proteicos entre sí. Estos complejos pueden ensamblarse aún más en filamentos, anillos y gasas. Ensambladas como tales, las septinas funcionan en las células localizando otras proteínas , ya sea proporcionando un andamio al que las proteínas pueden unirse o formando una barrera que impide la difusión de moléculas de un compartimento de la célula a otro, [2] [3] [ 4] [5] o en la corteza celular como barrera para la difusión de proteínas unidas a la membrana. [6]
Las septinas han sido implicadas en la localización de procesos celulares en el sitio de división celular y en la membrana celular en sitios donde estructuras especializadas como cilios o flagelos están unidas al cuerpo celular. [4] En las células de levadura, compartimentan partes de la célula y construyen andamios para proporcionar soporte estructural durante la división celular en el tabique , de donde derivan su nombre. [3] La investigación en células humanas sugiere que las septinas construyen jaulas alrededor de bacterias patógenas , que las inmovilizan y evitan que invadan otras células. [7]
Como proteínas formadoras de filamentos, las septinas pueden considerarse parte del citoesqueleto . [4] Además de formar filamentos no polares, las septinas se asocian con las membranas celulares , la corteza celular, los filamentos de actina y los microtúbulos . [4] [6]
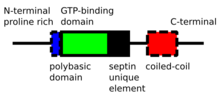
Las septinas son proteínas P-Loop -NTPasa que varían en peso entre 30 y 65 kDa. Los septinos están altamente conservados entre diferentes especies eucariotas. Están compuestos por un extremo N rico en prolina de longitud variable con un motivo de unión a fosfoinosítido básico importante para la asociación a la membrana, un dominio de unión a GTP , un dominio de elemento único de Septin altamente conservado y una extensión C-terminal que incluye un dominio en espiral de longitud variable. [4]
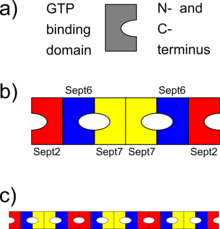
Los septinos interactúan a través de sus respectivos dominios de unión a GTP o a través de sus extremos N y C. Diferentes organismos expresan un número diferente de septinas y a partir de ellas se forman oligómeros simétricos. Por ejemplo, en levadura el complejo octamérico formado es Cdc11-Cdc12-Cdc3-Cdc10-Cdc10-Cdc3-Cdc12-Cdc11. [8] En los seres humanos, son posibles los complejos hexaméricos u octaméricos. Inicialmente se indicó que el complejo humano era Sept7-Sept6-Sept2-Sept2-Sept6-Sept7; [9] pero recientemente este orden ha sido revisado a Sept2-Sept6-Sept7-Sept7-Sept6-Sept2 [10] (o Sept2-Sept6-Sept7-Sept3-Sept3-Sept7-Sept6-Sept2 [11] en caso de hetero octamérico -oligómeros). Estos complejos luego se asocian para formar filamentos no polares, haces de filamentos, jaulas o estructuras anulares en las células. [4]
Las septinas se encuentran en hongos , animales y algunas algas eucariotas, pero no se encuentran en las plantas. [1]

Hay siete septinas diferentes en Saccharomyces cerevisiae . Cinco de ellos están involucrados en la mitosis, mientras que dos (Spr3 y Spr28) son específicos de la esporulación . [2] [3] Las septinas mitóticas (Cdc3, Cdc10, Cdc11, Cdc12, Shs1) forman una estructura de anillo en el cuello de la yema durante la división celular . [2] [4] Están involucrados en la selección del sitio de la yema, el posicionamiento del huso mitótico , el crecimiento polarizado y la citocinesis . Las septinas esporulantes (Spr3, Spr28) se localizan junto con Cdc3 y Cdc11 en los bordes de las membranas de las prosporas. [2]
Los septinos forman una región especializada en la corteza celular conocida como corteza septino. [12] La corteza septina sufre varios cambios a lo largo del ciclo celular : la primera estructura septina visible es un anillo distintivo que aparece ~15 minutos antes de la aparición de las yemas . Después de la aparición de las yemas , el anillo se ensancha hasta adoptar la forma de un reloj de arena alrededor del cuello de la yema madre. Durante la citocinesis , la corteza septina se divide en un doble anillo que finalmente desaparece. ¿Cómo puede la corteza septina sufrir cambios tan dramáticos, aunque algunas de sus funciones pueden requerir que sea una estructura estable? El análisis FRAP ha revelado que el recambio de septinas en el cuello sufre múltiples cambios durante el ciclo celular . La conformación funcional predominante se caracteriza por una baja tasa de renovación (estado congelado), durante la cual las septinas se fosforilan . Los cambios estructurales requieren una desestabilización de la corteza septina (estado fluido) inducida por la desfosforilación antes de la aparición de las yemas , la división del anillo y la separación celular . [3]
La composición de la corteza septina no sólo varía a lo largo del ciclo celular sino también a lo largo del eje madre-brote. Esta polaridad de la red septina permite la concentración de algunas proteínas principalmente en el lado madre del cuello, algunas en el centro y otras en el sitio de la yema .
Las septinas actúan como un andamio y reclutan muchas proteínas . Estos complejos proteicos están involucrados en la citocinesis , la deposición de quitina , la polaridad celular , la formación de esporas , en el punto de control de la morfogénesis , en el punto de control de la alineación del huso y en la selección del sitio de las yemas.
La citocinesis de la levadura en ciernes se impulsa a través de dos procesos redundantes dependientes de septina: reclutamiento y contracción del anillo de actomiosina y formación del tabique mediante la fusión de vesículas con la membrana plasmática . A diferencia de los mutantes de septina , la alteración de una única vía sólo provoca un retraso en la citocinesis , no un fallo completo de la división celular . Por lo tanto, se predice que las septinas actuarán en el nivel más ascendente de la citocinesis .
Después del cambio isotrópico - apical en la levadura en gemación , los componentes corticales , supuestamente del exociste y del polarisoma, se deslocalizan desde el polo apical a toda la membrana plasmática de la yema, pero no a la célula madre. El anillo septino en el cuello sirve como barrera cortical que previene la difusión por membrana de estos factores entre los dos compartimentos. Esta distribución asimétrica está abolida en los mutantes septin .
Algunos mutantes condicionales de septina no forman yemas en su ubicación axial normal. Además, en estos mutantes se pierde o se altera la localización típica de algunos factores de selección del sitio de la yema en un doble anillo en el cuello . Esto indica que las septinas pueden servir como sitio de anclaje para tales factores en células en gemación axial .
Desde su descubrimiento en S. cerevisiae , se han encontrado homólogos de septina en otras especies eucariotas , incluidos hongos filamentosos . Las septinas de los hongos filamentosos muestran una variedad de formas diferentes dentro de células individuales , donde controlan aspectos de la morfología filamentosa . [13] [14]
El genoma de C. albicans codifica homólogos de todas las septinas de S. cerevisiae . Sin los genes Cdc3 y Cdc12, Candida albicans no puede proliferar; otras septinas afectan la morfología y la deposición de quitina , pero no son esenciales. Candida albicans puede presentar diferentes morfologías de crecimiento vegetativo, lo que determina la aparición de estructuras septina. Las hifas recién formadas forman un anillo septino en la base, se forman anillos dobles en los sitios de septación de las hifas y se forma una tapa septina en las puntas de las hifas. Los filamentos alargados del septino rodean las clamidosporas esféricas . Los anillos dobles de septinas en el sitio de la septación también tienen polaridad de crecimiento, con el anillo de la punta en crecimiento desmontándose, mientras que el anillo basal permanece intacto. [13]
Se encuentran cinco septinas en A. nidulans (AnAspAp, AnAspBp, AnAspCp, AnAspDp, AnAspEp). AnAspBp forma anillos simples en los sitios de septación que eventualmente se dividen en anillos dobles. Además, AnAspBp forma un anillo en los sitios de emergencia de las ramas que se amplía hasta formar una banda a medida que la rama crece. Como en C. albicans , los anillos dobles reflejan la polaridad de la hifa . En el caso de Aspergillus nidulans, la polaridad se transmite mediante el desmontaje del anillo más basal (el anillo más alejado de la punta de crecimiento de las hifas), dejando intacto el anillo apical, potencialmente como una señal de guía del crecimiento. [2] [13]

El ascomiceto A. gossypii posee homólogos de todas las septinas de S. cerevisiae , una de las cuales está duplicada ( AgCDC3, AgCDC10, AgCDC11A, AgCDC11B, AgCDC12, AgSEP7 ). Los estudios in vivo de AgSep7p- GFP han revelado que las septinas se ensamblan en anillos hifales discontinuos cerca de las puntas de crecimiento y los sitios de formación de ramas, [2] y en estructuras asimétricas en la base de los puntos de ramificación. Los anillos están hechos de filamentos que son largos y difusos cerca de las puntas de crecimiento y cortos y compactos más lejos de la punta. Durante la formación del tabique , el anillo septino se divide en dos para formar un anillo doble. " Los mutantes por deleción Agcdc3Δ, Agcdc10Δ y Agcdc12Δ muestran una morfología aberrante y son defectuosos en la formación de anillos de actina , formación de anillos de quitina y esporulación" . Debido a la falta de septos , los mutantes por deleción de septina son muy sensibles y el daño de una sola hifa puede provocar la lisis completa de un micelio joven .
A diferencia de las septinas de la levadura y de otros componentes citoesqueléticos de los animales, las septinas no forman una red continua en las células, sino varias dispersas en el citoplasma de la corteza celular . Estos están integrados con haces de actina y microtúbulos . Por ejemplo, la proteína anilina, que agrupa actina, es necesaria para el control espacial correcto de la organización de la septina. [5] En los espermatozoides de los mamíferos , las septinas forman un anillo estable llamado anillo en la cola. En ratones (y potencialmente también en humanos), la formación defectuosa del anillo conduce a la infertilidad masculina. [4] [5]
En los seres humanos, las septinas participan en la citocinesis , la formación de cilios y la neurogénesis a través de la capacidad de reclutar otras proteínas o servir como barrera de difusión. Hay 13 genes humanos diferentes que codifican las septinas. Las proteínas septina producidas por estos genes se agrupan en cuatro subfamilias, cada una de las cuales lleva el nombre de su miembro fundador: (i) SEPT2 ( SEPT1 , SEPT4 , SEPT5 ), (ii) SEPT3 ( SEPT9 , SEPT12 ), (iii) SEPT6 ( SEPT8 , SEPT10 , SEPT11 , SEPT14 ), y (iv) SEPT7 . Los complejos proteicos de septina se ensamblan para formar heterohexámeros ( que incorporan monómeros seleccionados de tres grupos diferentes y el monómero de cada grupo está presente en dos copias; 3 x 2 = 6) o heterooctámeros ( monómeros de cuatro grupos diferentes, cada monómero presente en dos copias; 4 x 2 = 8). Estos heterooligómeros forman a su vez estructuras de orden superior, como filamentos y anillos. [4] [5] [1]
Los septinos forman estructuras en forma de jaula alrededor de bacterias patógenas , inmovilizando microbios dañinos e impidiendo que invadan células sanas. Este sistema de defensa celular podría potencialmente explotarse para crear terapias para la disentería y otras enfermedades . Por ejemplo, Shigella es una bacteria que causa diarrea letal en humanos. Para propagarse de una célula a otra, las bacterias Shigella desarrollan 'colas' de polímero de actina , que impulsan a los microbios y les permiten entrar en las células huésped vecinas. Como parte de la respuesta inmune, las células humanas producen una proteína de señalización celular llamada TNF-α que activa gruesos haces de filamentos de septina para rodear a los microbios dentro de la célula huésped infectada. [15] Los microbios que quedan atrapados en estas jaulas septina se descomponen mediante autofagia . [16] Las alteraciones en las septinas y las mutaciones en los genes que las codifican podrían estar involucradas en causar leucemia , cáncer de colon y afecciones neurodegenerativas como la enfermedad de Parkinson y la enfermedad de Alzheimer . Las terapias potenciales para estos, así como para afecciones bacterianas como la disentería causada por Shigella , podrían reforzar el sistema inmunológico del cuerpo con medicamentos que imiten el comportamiento del TNF-α y permitan que las jaulas de septina proliferen. [7]
En el gusano nematodo Caenorhabditis elegans hay dos genes que codifican septinas, y los complejos de septinas contienen las dos septinas diferentes en un complejo tetramérico UNC59-UNC61-UNC61-UNC59. Las septinas en C.elegans se concentran en el surco de escisión y en la parte media del cuerpo del huso durante la división celular . Las septinas también participan en la migración celular y la guía de axones en C.elegans . [2]
La septina localizada en las mitocondrias se llama septina mitocondrial (M-septina). Se identificó como una proteína que interactúa con CRMP /CRAM en el cerebro de rata en desarrollo. [17]
Las septinas fueron descubiertas en 1970 por Leland H. Hartwell y sus colegas en una selección de mutantes sensibles a la temperatura que afectan la división celular (mutantes cdc) en levadura ( Saccharomyces cerevisiae ). La pantalla reveló cuatro mutantes que impedían la citocinesis a temperatura restrictiva. Los genes correspondientes representan las cuatro septinas originales, ScCDC3, ScCDC10, ScCDC11 y ScCDC12 . [3] [4] A pesar de la alteración de la citocinesis, las células continuaron con la gemación , la síntesis de ADN y la división nuclear , lo que resultó en grandes células multinucleadas con múltiples yemas alargadas. En 1976, el análisis de micrografías electrónicas reveló ~20 estriaciones uniformemente espaciadas de filamentos de 10 nm alrededor del cuello de la yema madre en células de tipo salvaje, pero no en células mutantes de septina. [3] [4] [13] Los estudios de inmunofluorescencia revelaron que las proteínas septina se colocalizan en un anillo de septina en el cuello. [4] [13] La localización de las cuatro septinas está alterada en los mutantes condicionales Sccdc3 y Sccdc12 , lo que indica interdependencia de las proteínas septinas. Los estudios bioquímicos proporcionaron un fuerte apoyo a este hallazgo : las cuatro septinas originales se copurificaron en columnas de afinidad , junto con una quinta proteína septina, codificada por ScSEP7 o ScSHS1 . Las septinas purificadas de levaduras en ciernes, Drosophila , Xenopus y células de mamíferos pueden autoasociarse in vitro para formar filamentos. [13] En S. cerevisiae se estudió en detalle cómo interactúan las septinas in vitro para formar heterooligómeros que se ensamblan en filamentos .
Las micrografías de filamentos purificados plantearon la posibilidad de que las septinas estén organizadas en paralelo al eje madre-brote. Las estrías de 10 nm que se observan en las micrografías electrónicas pueden ser el resultado de la interacción lateral entre los filamentos. Las cepas mutantes que carecen de factores importantes para la organización de los septinos respaldan esta opinión. En lugar de anillos continuos, las septinas forman barras orientadas a lo largo del eje madre-brote en mutantes por deleción de ScGIN4, ScNAP1 y ScCLA4 .