La solución salina tamponada con fosfato ( PBS ) es una solución tampón (pH ~ 7,4) que se utiliza habitualmente en la investigación biológica . Es una solución salina a base de agua que contiene fosfato de hidrógeno disódico , cloruro de sodio y, en algunas formulaciones, cloruro de potasio y fosfato de dihidrógeno de potasio . El tampón ayuda a mantener un pH constante. La osmolaridad y las concentraciones de iones de las soluciones son isotónicas , lo que significa que coinciden con las del cuerpo humano.
El PBS tiene muchos usos porque es isotónico y no tóxico para la mayoría de las células. Estos usos incluyen la dilución de sustancias y el enjuague de contenedores de células. El PBS con EDTA también se utiliza para separar células adheridas y aglutinadas. Sin embargo, no se pueden agregar metales divalentes como el zinc , ya que esto provocaría precipitación. Para este tipo de aplicaciones, se recomiendan los tampones de Good . Se ha demostrado que el PBS es una alternativa aceptable al medio de transporte viral en lo que respecta al transporte y almacenamiento de virus de ARN, como el SARS-CoV-2. [1]
Existen muchas formas diferentes de preparar soluciones de PBS, las más comunes son la solución salina tamponada con fosfato de Dulbecco (DPBS) [2] y el protocolo Cold Spring Harbor. [3] Algunas formulaciones de DPBS no contienen potasio ni magnesio, mientras que otras contienen calcio y/o magnesio (dependiendo de si el tampón se utiliza en tejido vivo o fijado: este último no requiere CaCl2 o MgCl2 ) .
Comience con 800 ml de agua destilada para disolver todas las sales. Agregue agua destilada hasta un volumen total de 1 litro. El PBS 1× resultante tendrá una concentración final de 157 mM Na + , 140 mM Cl − , 4,45 mM K + , 10,1 mM HPO 4 2− , 1,76 mM H 2 PO 4 − y un pH de 7,96. Agregue 2,84 mM de HCl para cambiar el tampón a 7,3 mM HPO 4 2− y 4,6 mM H 2 PO 4 − para un pH final de 7,4 y una concentración de Cl − de 142 mM.
El pH del PBS es de ~7,4. Al preparar soluciones tampón, es recomendable medir siempre el pH directamente con un medidor de pH. Si es necesario, se puede ajustar el pH con ácido clorhídrico o hidróxido de sodio.
El PBS también se puede preparar utilizando tabletas o bolsas de tampón de PBS fabricadas comercialmente. [4]
Si se utiliza en cultivos celulares, la solución se puede distribuir en alícuotas y esterilizar mediante autoclave o filtración . La esterilización puede no ser necesaria según el uso. El PBS se puede almacenar a temperatura ambiente o en el refrigerador. Sin embargo, las soluciones madre concentradas pueden precipitar al enfriarse y deben mantenerse a temperatura ambiente hasta que el precipitado se haya disuelto por completo antes de su uso.
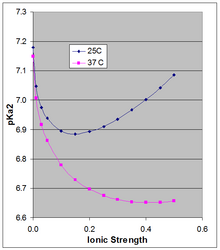
La ecuación de Henderson-Hasselbach proporciona el pH de una solución en relación con el p K a del par ácido-base. Sin embargo, el p K a depende de la fuerza iónica y la temperatura, y a medida que cambia, también lo hará el pH de una solución en función de ese par ácido-base. Debido a que el [HPO 4 ] 2− con doble carga se estabiliza más por una fuerza iónica alta que el [H 2 PO 4 ] − con una sola carga , su p K a depende en cierta medida de la fuerza iónica. El p K a de ~7,2, que se cita con frecuencia, es el valor extrapolado a una fuerza iónica cero y no es aplicable a una fuerza iónica fisiológica.
Phillips et al. [5] midieron el p K a a 10, 25 y 37 °C a distintas intensidades iónicas. Para las dos últimas temperaturas, informaron el p K a en ecuaciones de Debye-Hückel (graficadas en la figura adjunta para μ hasta 0,5 M):
a 25 °C: pKa 2 = 7,18 − 1,52 sqrt(μ) + 1,96 μ
a 37 °C: pKa 2 = 7,15 − 1,56 sqrt(μ) + 1,22 μ
El p K a 0 depende débilmente de la temperatura. Phillips et al. informaron un ∆H 0 a 25 °C de 760 cal/mol (3180 J/mol) y una dependencia lineal de p K a 0 en 1/ T ( ecuación de Van 't Hoff ). El ∆H 0 positivo resulta en un aumento en K a , y por lo tanto una disminución en p K a 0 con el aumento de la temperatura, siendo el cambio en pKa 0 166 × el cambio en (1/ T ), que alrededor de 25 °C resulta en un cambio en p K a 0 de −0,00187 por grado. Esto se aplica estrictamente al p K a 0 termodinámico extrapolado a dilución infinita y, como muestra la figura, el efecto de la temperatura puede ser mucho mayor a mayor fuerza iónica.