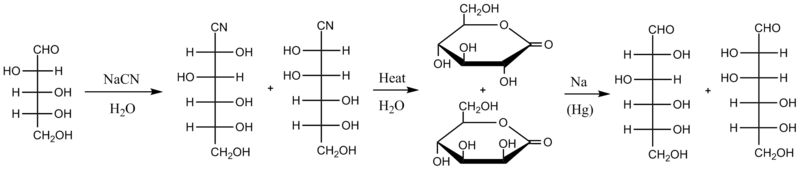
La síntesis de Kiliani-Fischer , llamada así por los químicos alemanes Heinrich Kiliani y Emil Fischer , es un método para sintetizar monosacáridos . Procede mediante la síntesis e hidrólisis de una cianhidrina , seguida de la reducción del ácido intermedio al aldehído, alargando así la cadena carbonada de una aldosa en un átomo de carbono mientras se preserva la estereoquímica en todos los carbonos quirales previamente presentes . El nuevo carbono quiral se produce con ambas estereoquímicas, por lo que el producto de una síntesis de Kiliani-Fischer es una mezcla de dos azúcares diastereoméricos , llamados epímeros . Por ejemplo, la D - arabinosa se convierte en una mezcla de D - glucosa y D - manosa .
La versión original de la síntesis de Kiliani-Fischer procede a través de intermediarios de cianhidrina y lactona de ácido aldónico . El primer paso es reaccionar el azúcar de partida con cianuro acuoso (típicamente NaCN); el cianuro sufre una adición nucleofílica al grupo carbonilo del azúcar (aunque los azúcares tienden a existir principalmente como hemiacetal cíclico , siempre están en equilibrio químico con sus formas de aldehído o cetona de cadena abierta , y en el caso de estas aldosas es esa forma de aldehído la que reacciona en esta síntesis). La cianhidrina resultante de esta adición se calienta en agua, lo que hidroliza el cianuro en un grupo de ácido carboxílico que reacciona rápidamente consigo mismo para formar una lactona más estable . Ahora hay dos lactonas diastereoméricas en la mezcla de reacción. Se separan (por cromatografía , se reparten en diferentes disolventes o cualquiera de los numerosos otros métodos de separación ) y luego la lactona deseada se reduce con una amalgama de sodio . Como se ilustra a continuación, la D - arabinosa se convierte en una mezcla de D -glucononitrilo y D -manononitrilo, que luego se convierte en D - gluconolactona y D -mannonolactona, se separa y se reduce a D - glucosa o D - manosa . Se estima que el rendimiento químico con este método es de alrededor del 30%.
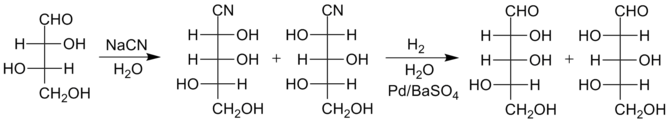
Más recientemente, se ha desarrollado un método de reducción mejorado que produce rendimientos algo mayores de los azúcares más grandes. En lugar de convertir la cianhidrina en una lactona, la cianhidrina se reduce con hidrógeno , utilizando paladio sobre sulfato de bario como catalizador y agua como disolvente , para formar una imina . Debido a la presencia de agua, la imina se hidroliza rápidamente para formar un aldehído, por lo que los azúcares finales se producen en solo dos pasos en lugar de tres. La separación de los isómeros se realiza entonces en la etapa de los propios productos de azúcar en lugar de en los intermedios de lactona. El catalizador especial es necesario para evitar una mayor reducción del grupo aldehído a un grupo hidroxilo , lo que produciría un alditol . Estos catalizadores que limitan la hidrogenación a un paso se denominan catalizadores envenenados; el paladio de Lindlar es otro ejemplo. Las reacciones a continuación ilustran este método mejorado para la conversión de L - treosa en L - lixosa y L - xilosa .
Ambos enantiómeros del gliceraldehído están disponibles comercialmente, por lo que se puede acceder a cualquier estereoisómero de aldosa de cualquier longitud de cadena mediante un número apropiado de aplicaciones repetidas de la síntesis de Kiliani-Fischer. La triosa D -gliceraldehído ( 1 ) conduce a las tetrosas D -eritrosa ( 2a ) y D -treosa ( 2b ). Estas conducen a las pentosas D -ribosa ( 3a ) y D -arabinosa ( 3b ), y D -xilosa ( 3c ) y D -lixosa ( 3d ), respectivamente. La siguiente iteración conduce a las hexosas D -alosa ( 4a ) y D -altrosa ( 4b ), D -glucosa ( 4c ) y D -manosa ( 4d ), D -gulosa ( 4e ) y D -idosa ( 4f ), y D -galactosa ( 4g ) y D -talosa ( 4h ). Las D - heptosas y posteriores están disponibles al continuar la secuencia, y la serie enantiomérica L está disponible al comenzar la secuencia con L -gliceraldehído.

En la práctica, la síntesis de Kiliani-Fischer se suele utilizar para la producción de azúcares que son difíciles o imposibles de obtener a partir de fuentes naturales. Si bien permite acceder a todos los estereoisómeros posibles de cualquier aldosa deseada, el proceso está limitado por su bajo rendimiento y el uso de reactivos tóxicos. Además, el proceso requiere disponer de un suministro del azúcar anterior de la serie, lo que puede requerir un trabajo de síntesis sustancial si no está disponible fácilmente. Por ejemplo, si se utilizan iteraciones sucesivas de la síntesis de Kiliani-Fischer, el rendimiento general cae aproximadamente de manera exponencial con cada iteración adicional.
El proceso sólo proporciona acceso directo a las aldosas, mientras que algunos azúcares de interés pueden ser cetosas. Algunas cetosas pueden ser accesibles a partir de aldosas similares por isomerización a través de un intermediario enediol ; por ejemplo, al permanecer en una base acuosa, la glucosa , la fructosa y la manosa se interconvertirán lentamente ya que comparten una forma enediol. (Véase la transformación de Lobry de Bruyn–van Ekenstein ). Algunos azúcares inusuales también son accesibles a través de la adición aldólica .