En enzimología , una deshidrogenasa de retinal , también conocida como retinaldehído deshidrogenasa ( RALDH ), cataliza la reacción química que convierte el retinal en ácido retinoico . Esta enzima pertenece a la familia de las oxidorreductasas , específicamente a la clase que actúa sobre grupos donantes de aldehído u oxo- con NAD + o NADP + como grupos aceptores, siendo el nombre sistemático retinal:NAD + oxidorreductasa . Esta enzima participa en el metabolismo del retinol . El esquema general de la reacción catalizada por esta enzima es:
retinal + NAD + + H 2 O ácido retinoico + NADH + H +
La deshidrogenasa retiniana es un tetrámero de unidades idénticas, que consiste en un dímero de dímeros. [1] Los monómeros de la deshidrogenasa retiniana se componen de tres dominios: un dominio de unión de nucleótidos , un dominio de tetramerización y un dominio catalítico. El dímero puede representarse como una "X" con los dímeros formando mitades superior e inferior que se cruzan entre sí. Curiosamente, el dominio de unión de nucleótidos de la deshidrogenasa retiniana contiene 5 en lugar de las 6 cadenas β habituales en el pliegue de Rossman . [2] Esto parece estar conservado en muchas deshidrogenasas de aldehído. Los dominios de tetramerización se encuentran ecuatorialmente a lo largo de la "X" y las regiones de unión de nucleótidos aparecen en las puntas de la "X". Cerca del dominio de tetramerización se encuentra un túnel de 12 Å de profundidad que da acceso al sustrato a las regiones catalíticas clave. [1] Se ha descubierto que los residuos cerca del extremo C-terminal del dominio catalítico imparten especificidad en otras aldehído deshidrogenasas. Muchas aldehído deshidrogenasas tienen en común una cisteína catalítica , que se encontró presente en RALDH2, una retina deshidrogenasa específica para la que se ha resuelto la estructura. [1] [3] [4]

Hay tres clases generales de aldehído deshidrogenasas: la clase 1 (ALDH1) comprende proteínas citosólicas , la clase 2 (ALDH2) incluye proteínas mitocondriales y la clase 3 (ALDH3) incluye proteínas relacionadas con tumores . [4] Las enzimas ALDH1 muestran una alta especificidad para el retinal todo-trans y el retinal 9-cis en estudios cinéticos de aldehído deshidrogenasas de hígado de oveja, mientras que las enzimas ALDH2 muestran poca afinidad por el retinal y, en cambio, parecen estar involucradas principalmente en la oxidación del acetaldehído . [5] [6] El túnel de entrada al sitio activo de la enzima parece proporcionar la especificidad observada en ALDH1 para el retinal como sustrato. El tamaño del túnel es clave para impartir esta especificidad: el diámetro accesible al solvente del túnel de entrada es de 150 Å 3 en ALDH1, por lo que se puede acomodar el retinal relativamente grande, mientras que el diámetro accesible al solvente en ALDH2 es de solo 20 Å 3, lo que limita la accesibilidad al retinal pero acomoda ampliamente el acetaldehído. [7]
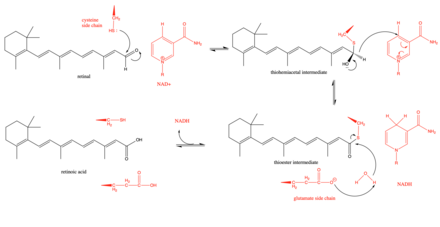
El mecanismo propuesto de la retina deshidrogenasa comienza con un residuo de cisteína clave en el sitio activo que ataca al grupo aldehído en la retina para formar un intermediario tiohemiacetal. [3] Luego, la enzima facilita un cambio de hidruro para formar NADH y un intermediario tioéster . Se ha demostrado que este cambio de hidruro es estereoespecífico en un subconjunto (clase 3) de retina deshidrogenasas. [8] Luego, el intermediario tioéster es atacado por una molécula de agua, que se vuelve más nucleófila por un residuo de glutamato que se encuentra cerca del sitio activo. [9] Ha habido cierto debate sobre si el residuo de glutamato cerca del sitio activo actúa como una base general durante la reacción o si es más limitado y simplemente desprotona la cisteína catalítica para hacer que la cisteína sea más nucleófila. [9] Los estudios cinéticos han respaldado este mecanismo al mostrar que la reacción sigue una ruta secuencial ordenada con la unión de NAD + primero, seguida por la unión de retinal, la descomposición catalítica de retinal a ácido retinoico, la liberación de ácido retinoico y, finalmente, la liberación de NADH. [10]
Algunas de las estrategias para regular las deshidrogenasas retinianas recién ahora se están volviendo más claras después de que la regulación in vivo permaneció misteriosa por algún tiempo, aunque gran parte de la investigación actual sobre regulación se ha centrado en la modulación de la expresión genética en lugar de la regulación proteica directa. [7] Las células dendríticas en el intestino ayudan a modular la tolerancia inmunológica a través de la actividad de la deshidrogenasa retiniana; la expresión en estas células puede ser impulsada por un receptor TNF , 4-1-BB . [11] También se demostró que la expresión de cierta deshidrogenasa retiniana encontrada en humanos, la deshidrogenasa/reductasa de cadena corta retiniana (retSDR1), aumenta con las proteínas supresoras de tumores p53 y p63, lo que sugiere que retSDR1 puede tener actividades de prevención de tumores. [12] La expresión de los genes de los tipos 1 y 2 de la deshidrogenasa retiniana se mejora con la adición de colesterol o derivados del colesterol. [13] El disulfiram es un fármaco utilizado para regular artificialmente la actividad de la aldehído deshidrogenasa en pacientes con alcoholismo inhibiendo la actividad de las aldehído deshidrogenasas, aunque no es específico de la deshidrogenasa retiniana. [14] También se ha descubierto que otras moléculas exógenas inhiben la actividad de la deshidrogenasa retiniana, entre ellas el nitrofeno , el ácido 4-bifenilcarboxílico , la bisdiamina y el SB-210661. [15]
La deshidrogenasa retiniana desempeña un papel clave en la biosíntesis del ácido retinoico, que a su vez actúa en las vías de señalización celular. El ácido retinoico se distingue de otras moléculas de señalización celular en que se difunde en el núcleo y se une directamente a los genes diana a través de los receptores de ácido retinoico . [16] Esta vía de señalización del ácido retinoico también parece ser exclusiva de los cordados , como lo sugiere la presencia de deshidrogenasas retinianas exclusivamente en los cordados. [17] La señalización del ácido retinoico parece controlar procesos de desarrollo como la neurogénesis , la cardiogénesis , el desarrollo de la yema de las extremidades anteriores , el desarrollo del intestino anterior y el desarrollo del ojo . La señalización del ácido retinoico también es importante para mantener el tipo de célula neuronal y epitelial adulta . [18] El ácido retinoico se genera en los organismos oxidando primero el retinol ( vitamina A ) a retinal con una alcohol deshidrogenasa . Luego, una deshidrogenasa retiniana oxida el retinal a ácido retinoico. La producción de ácido retinoico a partir de vitamina A debe controlarse estrictamente, ya que los niveles elevados de ácido retinoico y vitamina A pueden provocar efectos tóxicos, mientras que la deficiencia de vitamina A conlleva sus propios problemas en el desarrollo. [19] [20] Esto proporciona una justificación para muchas de las estrategias de regulación transcripcional analizadas anteriormente. En los seres humanos, las mutaciones en un gen que codifica una determinada deshidrogenasa retiniana ( RDH12 ) también pueden provocar amaurosis congénita de Leber , una distrofia retiniana responsable de muchos casos de ceguera congénita . [21]
Existen diferentes isoformas de la deshidrogenasa retiniana y desempeñan un papel clave en el desarrollo, ya que los tipos se expresan de forma diferencial dentro de un embrión en desarrollo . La enzima deshidrogenasa retiniana tipo 2 (RALDH2) cataliza gran parte de la formación de ácido retinoico durante el desarrollo, pero no toda. RALDH2 es crucial para el desarrollo a mitad de la gestación y ayuda a impulsar el desarrollo neuronal, cardíaco, pulmonar y de las extremidades anteriores; también es responsable de todo el desarrollo de ácido retinoico durante ciertos períodos de la mitad de la gestación. [22] Más adelante en el desarrollo, la deshidrogenasa retiniana tipo 1 (RALDH1) comienza a funcionar en la fosa dorsal de la retina y la deshidrogenasa retiniana tipo 3 (RALDH3) se activa en la fosa olfatoria , la retina ventral y el tracto urinario . La inactivación del gen Raldh2 es fatal en ratones durante el desarrollo, ya que el cerebro no puede desarrollarse normalmente. [23] La inactivación del gen Raldh3 es fatal al nacer en ratones, ya que los conductos nasales no se desarrollan adecuadamente y, en cambio, están bloqueados. [24] La eliminación de Raldh1 no es fatal y, curiosamente, se ha demostrado que protege contra la obesidad inducida por la dieta en ratones de una manera independiente de los retinoides . [25]