Un reordenamiento alílico o desplazamiento alílico es una reacción química orgánica en la que la reacción en un centro vecino a un doble enlace hace que el doble enlace se desplace a un par de átomos adyacentes:

Se encuentra tanto en la sustitución nucleofílica como en la electrófila , aunque generalmente está suprimida en relación con la sustitución no alílica. Por ejemplo, la reacción de 1-cloro-2-buteno con hidróxido de sodio da 2-buten-1-ol y 3-buten-2-ol:

En una sustitución similar del 1-cloro-3-metil-2-buteno, el 2-metil-3-buten-2-ol secundario se produce con un rendimiento del 85%, mientras que el 3-metil-2-ol primario buten-1-ol es del 15%.
Los cambios alílicos ocurren porque el estado de transición es un intermedio alílico . En otros aspectos , son similares a la sustitución nucleofílica clásica y admiten mecanismos tanto bimoleculares como monomoleculares (respectivamente las sustituciones SN 2 ' y SN 1 '/SN i ' ).
Los cambios alílicos se convierten en la vía de reacción dominante cuando hay una resistencia sustancial a una sustitución normal (no alílica). Para la sustitución nucleofílica, dicha resistencia se conoce cuando hay un impedimento estérico sustancial en o alrededor del grupo saliente , o si hay un sustituyente geminal que desestabiliza una acumulación de carga positiva. Los efectos de la sustitución en el grupo vinilo son menos claros. [1]
Aunque son aún más raros que S N ', los cambios alílicos pueden ocurrir de forma viníloga, como un "desplazamiento butadienílico": [2]
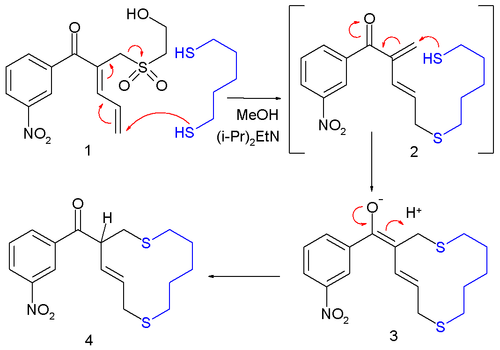
En la reducción de S N 2' , un hidruro desplaza alílicamente un buen grupo saliente en una reducción orgánica formal , similar a la síntesis del dieno de Whiting . Un ejemplo ocurrió en la síntesis total de taxol (anillo C): [3]
El hidruro es hidruro de litio y aluminio y el grupo saliente una sal de fosfonio ; el desplazamiento alílico provoca el doble enlace exocíclico en el producto. Sólo cuando el anillo de ciclohexano esté adecuadamente sustituido el protón agregará trans al grupo metilo adyacente .
Los cambios de alilo también pueden tener lugar con electrófilos . En el siguiente ejemplo, el grupo carbonilo del benzaldehído se activa con ácido diborónico antes de la reacción con el alcohol alílico (ver: reacción de Prins ): [4]
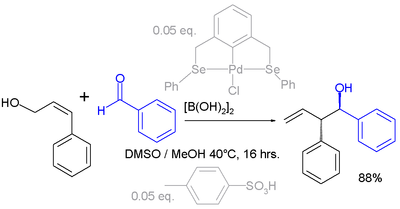
El sistema catalítico activo en esta reacción es una combinación de un compuesto de pinza de paladio y ácido p -toluenosulfónico ; el producto de la reacción se obtiene como un único regioisómero y estereoisómero .
Los cambios alílicos repetidos pueden "cambiar" un doble enlace entre dos posibles ubicaciones: [5]
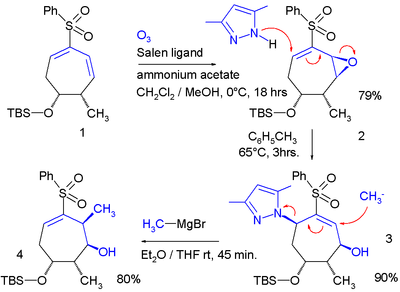
Una reacción S N 2' debería explicar el resultado de la reacción de una aziridina que lleva un grupo bromuro de metileno con metil litio : [6]
En esta reacción se pierde un equivalente de acetileno .