
La regla del octeto es una regla empírica química que refleja la teoría de que los elementos del grupo principal tienden a unirse de tal manera que cada átomo tiene ocho electrones en su capa de valencia , lo que le da la misma configuración electrónica que un gas noble . La regla es especialmente aplicable al carbono , nitrógeno , oxígeno y los halógenos ; aunque de manera más general la regla es aplicable para el bloque s y el bloque p de la tabla periódica . Existen otras reglas para otros elementos, como la regla del duplete para el hidrógeno y el helio , y la regla de los 18 electrones para los metales de transición .
Los electrones de valencia se pueden contar utilizando un diagrama de puntos de electrones de Lewis como se muestra a la derecha para el dióxido de carbono. Los electrones compartidos por los dos átomos en un enlace covalente se cuentan dos veces, una para cada átomo. En el dióxido de carbono, cada oxígeno comparte cuatro electrones con el carbono central, dos (mostrados en rojo) del propio oxígeno y dos (mostrados en negro) del carbono. Estos cuatro electrones se cuentan tanto en el octeto de carbono como en el octeto de oxígeno, de modo que se considera que ambos átomos obedecen la regla del octeto.
El enlace iónico es común entre pares de átomos, donde uno del par es un metal de baja electronegatividad (como el sodio ) y el segundo un no metal de alta electronegatividad (como el cloro ).
Un átomo de cloro tiene siete electrones en su tercera y más externa capa electrónica, estando la primera y la segunda capa ocupadas por dos y ocho electrones respectivamente. La primera afinidad electrónica del cloro (la energía liberada cuando el cloro gana un electrón para formar Cl − ) es de 349 kJ por mol de átomos de cloro. [1] Añadir un segundo electrón para formar un hipotético Cl 2- requeriría energía, energía que no puede recuperarse mediante la formación de un enlace químico. El resultado es que el cloro formará muy a menudo un compuesto en el que tiene ocho electrones en su capa externa (un octeto completo), como en el caso del Cl − .
Un átomo de sodio tiene un solo electrón en su capa electrónica más externa, la primera y la segunda capa están nuevamente llenas con dos y ocho electrones respectivamente. Para eliminar este electrón externo solo se requiere la primera energía de ionización , que es +495,8 kJ por mol de átomos de sodio, una pequeña cantidad de energía. Por el contrario, el segundo electrón reside en la segunda capa electrónica más profunda, y la segunda energía de ionización requerida para su eliminación es mucho mayor: +4562 kJ por mol. [2] Por lo tanto, el sodio, en la mayoría de los casos, formará un compuesto en el que ha perdido un solo electrón y tendrá una capa externa llena de ocho electrones, u octeto.
La energía necesaria para transferir un electrón de un átomo de sodio a un átomo de cloro (la diferencia entre la primera energía de ionización del sodio y la afinidad electrónica del cloro) es pequeña: +495,8 − 349 = +147 kJ mol −1 . Esta energía se compensa fácilmente con la energía reticular del cloruro de sodio : −783 kJ mol −1 . [3] Esto completa la explicación de la regla del octeto en este caso.

En 1864, el químico inglés John Newlands clasificó los sesenta y dos elementos conocidos en ocho grupos, basándose en sus propiedades físicas. [4] [5] [6] [7]
A finales del siglo XIX se sabía que los compuestos de coordinación (antes llamados «compuestos moleculares») se formaban por la combinación de átomos o moléculas de tal manera que las valencias de los átomos implicados aparentemente se satisfacían. En 1893, Alfred Werner demostró que el número de átomos o grupos asociados a un átomo central (el « número de coordinación ») es a menudo 4 o 6; se conocían otros números de coordinación hasta un máximo de 8, pero menos frecuentes. [8] En 1904, Richard Abegg fue uno de los primeros en ampliar el concepto de número de coordinación a un concepto de valencia en el que distinguió a los átomos como donantes o aceptores de electrones, lo que dio lugar a estados de valencia positivos y negativos que se asemejan mucho al concepto moderno de estados de oxidación . Abegg observó que la diferencia entre las valencias máximas positivas y negativas de un elemento bajo su modelo es frecuentemente ocho. [9] En 1916, Gilbert N. Lewis se refirió a esta idea como la regla de Abegg y la utilizó para ayudar a formular su modelo de átomo cúbico y la "regla de ocho", que comenzó a distinguir entre electrones de valencia y electrones de valencia . [10] En 1919, Irving Langmuir refinó estos conceptos aún más y los rebautizó como "átomo octeto cúbico" y "teoría del octeto". [11] La "teoría del octeto" evolucionó hasta convertirse en lo que ahora se conoce como la "regla del octeto".
Walther Kossel [12] y Gilbert N. Lewis observaron que los gases nobles no tenían tendencia a participar en reacciones químicas en condiciones normales. Basándose en esta observación, concluyeron que los átomos de los gases nobles son estables y, basándose en esta conclusión, propusieron en 1916 una teoría de la valencia conocida como "teoría electrónica de la valencia":
Durante la formación de un enlace químico, los átomos se combinan entre sí ganando, perdiendo o compartiendo electrones de tal manera que adquieren la configuración de gas noble más cercana. [13]
La teoría cuántica del átomo explica los ocho electrones como una capa cerrada con una configuración electrónica s 2 p 6 . Una configuración de capa cerrada es aquella en la que los niveles de energía más bajos están llenos y los niveles de energía más altos están vacíos. Por ejemplo, el estado fundamental del átomo de neón tiene una capa n = 2 llena (2s 2 2p 6 ) y una capa n = 3 vacía . Según la regla del octeto, los átomos inmediatamente anteriores y posteriores al neón en la tabla periódica (es decir, C, N, O, F, Na, Mg y Al) tienden a alcanzar una configuración similar al ganar, perder o compartir electrones.
El átomo de argón tiene una configuración análoga 3s 2 3p 6. También existe un nivel 3d vacío, pero se encuentra a una energía considerablemente mayor que 3s y 3p (a diferencia del átomo de hidrógeno), de modo que 3s 2 3p 6 todavía se considera una capa cerrada para fines químicos. Los átomos inmediatamente anteriores y posteriores al argón tienden a alcanzar esta configuración en los compuestos. Sin embargo, existen algunas moléculas hipervalentes en las que el nivel 3d puede desempeñar un papel en el enlace, aunque esto es controvertido (ver más abajo).
Según la teoría cuántica, en el caso del helio no existe un nivel 1p, por lo que 1s 2 es una capa cerrada sin electrones p. Los átomos anteriores y posteriores al helio (H y Li) siguen una regla de dúo y tienden a tener la misma configuración 1s 2 que el helio.
Muchos intermediarios reactivos son inestables y no obedecen la regla del octeto. Esto incluye especies como los carbenos , así como los radicales libres y el radical metilo (CH 3 ), que tiene un electrón desapareado en un orbital no enlazante en el átomo de carbono y ningún electrón de espín opuesto en el mismo orbital. Otro ejemplo es el radical monóxido de cloro (ClO • ) que está involucrado en el agotamiento del ozono . Estas moléculas a menudo reaccionan de manera que completan su octeto. Las moléculas deficientes en electrones, como los boranos, tampoco obedecen la regla del octeto, sino que comparten electrones deslocalizados de una manera similar al enlace metálico .
Aunque comúnmente se enseña que las moléculas estables con electrones impares y las moléculas hipervalentes violan la regla del octeto, los cálculos de orbitales moleculares ab initio muestran que en gran medida obedecen a la regla del octeto (ver las secciones sobre enlaces de tres electrones y moléculas hipervalentes a continuación).

Algunos radicales moleculares estables (por ejemplo, óxido nítrico , NO) obtienen configuraciones de octeto por medio de un enlace de tres electrones que aporta un electrón compartido y uno no compartido al octeto de cada átomo enlazado. [14] En NO, el octeto de cada átomo consta de dos electrones del enlace de tres electrones, más cuatro electrones de dos enlaces de dos electrones y dos electrones de un par solitario de electrones no enlazantes en ese átomo solo. El orden de enlace es 2,5, ya que cada enlace de dos electrones cuenta como un enlace mientras que el enlace de tres electrones solo tiene un electrón compartido y, por lo tanto, corresponde a un semienlace.
El dioxígeno a veces se representa como obedeciendo la regla del octeto con un doble enlace (O=O) que contiene dos pares de electrones compartidos. [15] Sin embargo, el estado fundamental de esta molécula es paramagnético , lo que indica la presencia de electrones desapareados. Pauling propuso que esta molécula en realidad contiene dos enlaces de tres electrones y un enlace covalente normal (de dos electrones). [16] El octeto de cada átomo consta entonces de dos electrones de cada enlace de tres electrones, más los dos electrones del enlace covalente, más un par solitario de electrones no enlazantes. El orden de enlace es 1+0,5+0,5=2.
Los elementos del grupo principal en la tercera y posteriores filas de la tabla periódica pueden formar moléculas hipercoordinadas o hipervalentes en las que el átomo central del grupo principal está unido a más de otros cuatro átomos, como el pentafluoruro de fósforo , PF 5 , y el hexafluoruro de azufre , SF 6 . Por ejemplo, en el PF 5 , si se supone que hay cinco enlaces covalentes verdaderos en los que se comparten cinco pares de electrones distintos, entonces el fósforo estaría rodeado por 10 electrones de valencia en violación de la regla del octeto. En los primeros días de la mecánica cuántica, Pauling propuso que los átomos de la tercera fila pueden formar cinco enlaces utilizando un orbital s, tres p y uno d, o seis enlaces utilizando un orbital s, tres p y dos d. [17] Para formar cinco enlaces, los orbitales s, tres p y uno d se combinan para formar cinco orbitales híbridos sp 3 d que comparten cada uno un par de electrones con un átomo de halógeno, para un total de 10 electrones compartidos, dos más de lo que predice la regla del octeto. De manera similar para formar seis enlaces, los seis orbitales híbridos sp 3 d 2 forman seis enlaces con 12 electrones compartidos. [18] En este modelo, la disponibilidad de orbitales d vacíos se utiliza para explicar el hecho de que los átomos de la tercera fila, como el fósforo y el azufre, pueden formar más de cuatro enlaces covalentes, mientras que los átomos de la segunda fila, como el nitrógeno y el oxígeno, están estrictamente limitados por la regla del octeto. [19]
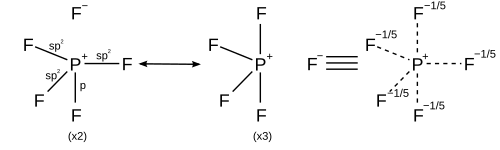
Sin embargo, otros modelos describen el enlace utilizando solo orbitales s y p de acuerdo con la regla del octeto. Una descripción del enlace de valencia de PF 5 utiliza resonancia entre diferentes estructuras PF 4 + F − , de modo que cada F está unido por un enlace covalente en cuatro estructuras y un enlace iónico en una estructura. Cada estructura de resonancia tiene ocho electrones de valencia en P. [20] Una descripción de la teoría de orbitales moleculares considera que el orbital molecular más alto ocupado es un orbital no enlazante localizado en los cinco átomos de flúor, además de cuatro orbitales enlazantes ocupados, por lo que nuevamente hay solo ocho electrones de valencia en el fósforo. [ cita requerida ] La validez de la regla del octeto para moléculas hipervalentes está respaldada además por cálculos de orbitales moleculares ab initio , que muestran que la contribución de las funciones d a los orbitales enlazantes es pequeña. [21] [22]
Sin embargo, por razones históricas, las estructuras que implican más de ocho electrones alrededor de elementos como P, S, Se o I aún son comunes en libros de texto y artículos de investigación. A pesar de la poca importancia de la expansión de la capa d en el enlace químico, esta práctica permite mostrar estructuras sin usar una gran cantidad de cargas formales o usar enlaces parciales y es recomendada por la IUPAC como un formalismo conveniente en preferencia a representaciones que reflejen mejor el enlace. Por otro lado, mostrar más de ocho electrones alrededor de Be, B, C, N, O o F (o más de dos alrededor de H, He o Li) es considerado un error por la mayoría de las autoridades.
La regla del octeto solo se aplica a los elementos del grupo principal . Otros elementos siguen otras reglas de conteo de electrones , ya que sus configuraciones electrónicas de valencia son diferentes a las de los elementos del grupo principal. Estas otras reglas se muestran a continuación:
La fuente arroja un cambio de entalpía de -349 kJ que corresponde a una liberación de energía de +349 kJ.
{{cite book}}: |first2=tiene nombre genérico ( ayuda )CS1 maint: multiple names: authors list (link)