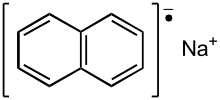
En química orgánica , un anión radical es una especie de radical libre [1] que lleva una carga negativa . Los aniones radicales se encuentran en química orgánica como derivados reducidos de compuestos aromáticos policíclicos, por ejemplo, naftenuro de sodio . Un ejemplo de un anión radical no carbonado es el anión superóxido , formado por la transferencia de un electrón a una molécula de oxígeno . Los aniones radicales se indican típicamente mediante .
Muchos compuestos aromáticos pueden sufrir una reducción de un electrón por metales alcalinos . El electrón se transfiere del ion de metal alcalino a un orbital antienlazante pp п* desocupado de la molécula aromática. Esta transferencia normalmente solo es energéticamente favorable si el disolvente aprótico solvata eficientemente el ion de metal alcalino. Los disolventes eficaces son aquellos que se unen al catión de metal alcalino: éter dietílico < THF < 1,2-dimetoxietano < HMPA . En principio, cualquier molécula insaturada puede formar un anión radical, pero los orbitales antienlazantes solo son energéticamente accesibles en sistemas conjugados más extensos. La facilidad de formación está en el orden benceno < naftaleno < antraceno < pireno , etc. Las sales de los aniones radicales a menudo no se aíslan como sólidos, sino que se utilizan in situ. Suelen estar profundamente coloreadas.
El ciclooctatetraeno se reduce mediante potasio elemental al dianión. El dianión resultante es un sistema electrónico de 10 pi, que se ajusta a la regla de Huckel para aromaticidad . La quinona se reduce a un anión radical semiquinona . Las semidionas se derivan de la reducción de compuestos dicarbonílicos.
Los aniones radicales pi se utilizan como agentes reductores en síntesis especializadas. Al ser solubles en al menos algunos disolventes, estas sales actúan más rápido que los propios metales alcalinos. Las desventajas son que el hidrocarburo policíclico debe eliminarse. El potencial de reducción de las sales de naftaleno de metales alcalinos es de aproximadamente 3,1 V (frente a Fc +/0 ). Los potenciales de reducción de los sistemas más grandes son más bajos, por ejemplo, el acenaftaleno es de 2,45 V. [7] Muchos aniones radicales son susceptibles de una mayor reducción a dianiones.
La adición de una fuente de protones (incluso agua) a un anión radical produce protonación, es decir, la secuencia de reducción seguida de protonación es equivalente a la hidrogenación . Por ejemplo, el anión radical antraceno forma principalmente (pero no exclusivamente) 9,10-dihidroantraceno. Los aniones radicales y su protonación son fundamentales para la reducción de Birch .
Los aniones radicales de compuestos aromáticos policíclicos funcionan como ligandos en la química organometálica . [8]
Las especies radicales catiónicas son mucho menos comunes que los aniones. Denominadas , aparecen de forma destacada en la espectrometría de masas. [9] Cuando una molécula en fase gaseosa se somete a ionización electrónica, un electrón es abstraído por un electrón en el haz de electrones para crear un catión radical M +. . Esta especie representa el ion molecular o ion parental. Un espectro de masas típico muestra múltiples señales porque el ion molecular se fragmenta en una mezcla compleja de iones y especies radicales sin carga. Por ejemplo, el catión radical metanol se fragmenta en un catión metenio CH+3y un radical hidroxilo . En el naftaleno, el catión radical no fragmentado es, con diferencia, el pico más destacado del espectro de masas. Las especies secundarias se generan a partir de la ganancia de protones (M+1) y la pérdida de protones (M-1).
Algunos compuestos que contienen el catión dioxigenilo se pueden preparar en masa. [10]
Los cationes radicales ocupan un lugar destacado en la química y las propiedades de los polímeros conductores . Dichos polímeros se forman por oxidación de heterociclos para dar cationes radicales, que se condensan con el heterociclo original. Por ejemplo, el polipirrol se prepara por oxidación del pirrol utilizando cloruro férrico en metanol:
Una vez formados, estos polímeros se vuelven conductores por oxidación. [11] Los polarones y bipolarones son cationes radicales que se encuentran en polímeros conductores dopados.