En las reacciones de sustitución aromática electrofílica , los grupos sustituyentes existentes en el anillo aromático influyen en la velocidad general de la reacción o tienen un efecto directivo sobre el isómero posicional de los productos que se forman.
Un grupo donador de electrones ( EDG ) o grupo liberador de electrones ( ERG , Z en fórmulas estructurales) es un átomo o grupo funcional que dona parte de su densidad electrónica a un sistema π conjugado a través de resonancia (mesomería) o efectos inductivos (o inducción), llamados efectos +M o +I , respectivamente, lo que hace que el sistema π sea más nucleofílico . [1] [2] Como resultado de estos efectos electrónicos , es más probable que un anillo aromático al que esté unido dicho grupo participe en una reacción de sustitución electrofílica . Por lo tanto, los EDG a menudo se conocen como grupos activadores , aunque los efectos estéricos pueden interferir con la reacción.
Un grupo atractor de electrones (EWG) tendrá el efecto opuesto en la nucleofilia del anillo. El EWG elimina la densidad electrónica de un sistema π, haciéndolo menos reactivo en este tipo de reacción, [2] [3] y por lo tanto llamados grupos desactivadores .
Los grupos EDG y EWG también determinan las posiciones (en relación con ellos mismos) en el anillo aromático donde es más probable que se produzcan reacciones de sustitución. Los grupos donantes de electrones son generalmente directores orto/para para sustituciones aromáticas electrofílicas , mientras que los grupos atractores de electrones (excepto los halógenos ) son generalmente directores meta . Las selectividades observadas con los grupos EDG y EWG se describieron por primera vez en 1892 y se conocen como la regla de Crum Brown-Gibson. [4]

Los grupos donadores de electrones se dividen típicamente en tres niveles de capacidad activadora (la categoría "extrema" puede verse como "fuerte"). Los grupos atractores de electrones se asignan a agrupaciones similares. Los sustituyentes activadores favorecen la sustitución electrofílica sobre las posiciones orto y para . Los grupos débilmente desactivadores dirigen a los electrófilos para que ataquen la molécula de benceno en las posiciones orto y para , mientras que los grupos fuerte y moderadamente desactivadores dirigen los ataques a la posición meta . [5] Este no es un caso de favorecer la posición meta como los grupos funcionales directores para y orto, sino más bien desfavorecer las posiciones orto y para más de lo que desfavorecen la posición meta .
Los grupos activadores son en su mayoría donantes de resonancia (+M). Aunque muchos de estos grupos también son receptores inductivos de (–I), lo que es un efecto desactivador, el efecto de resonancia (o mesomérico) es casi siempre más fuerte, con excepción de Cl, Br e I.
En general, el efecto de resonancia de los elementos del tercer período y posteriores es relativamente débil. Esto se debe principalmente a la superposición orbital relativamente pobre del orbital 3p (o superior) del sustituyente con el orbital 2p del carbono.
Debido a un efecto de resonancia y un efecto inductivo más fuertes que los halógenos más pesados, el flúor es anómalo. El factor de velocidad parcial de la sustitución aromática electrofílica en el fluorobenceno es a menudo mayor que uno en la posición para , lo que lo convierte en un grupo activador. [11] Por el contrario, se desactiva moderadamente en las posiciones orto y meta , debido a la proximidad de estas posiciones al sustituyente flúor electronegativo.
Si bien todos los grupos desactivantes se retiran inductivamente (–I), la mayoría de ellos también se retiran por resonancia (–M). Los sustituyentes halógenos son una excepción: son donantes de resonancia (+M). Con excepción de los haluros, son grupos directores meta .
Los haluros son grupos directores orto- para pero , a diferencia de la mayoría de los directores orto- para , los haluros desactivan levemente el areno. Este comportamiento inusual se puede explicar por dos propiedades:
Las propiedades inductivas y de resonancia compiten entre sí, pero el efecto de resonancia domina a los efectos de dirigir los sitios de reactividad. Para la nitración, por ejemplo, el flúor se dirige fuertemente a la posición para porque la posición orto se desactiva inductivamente (86% para , 13% orto , 0,6% meta ). Por otro lado, el yodo se dirige a las posiciones orto y para de manera comparable (54% para y 45% orto , 1,3% meta ). [12]
Aunque la estructura electrónica completa de un areno sólo se puede calcular utilizando la mecánica cuántica , los efectos directivos de diferentes sustituyentes a menudo se pueden adivinar mediante el análisis de diagramas de resonancia.

En concreto, cualquier carga formal negativa o positiva en los contribuyentes de resonancia menores (aquellos que están de acuerdo con la polarización natural pero no necesariamente obedecen la regla del octeto ) reflejan ubicaciones que tienen una mayor o menor densidad de carga en el orbital molecular para un enlace con más probabilidades de romperse . Un átomo de carbono con un coeficiente mayor será atacado preferentemente, debido a una superposición orbital más favorable con el electrófilo. [16]
La perturbación de un grupo conjugante que atrae o dona electrones hace que la distribución de electrones π en un anillo de benceno se parezca (¡ muy levemente !) a un catión bencílico deficiente en electrones o a un anión bencílico con exceso de electrones, respectivamente. La última especie admite un cálculo cuántico manejable utilizando la teoría de Hückel : el catión retira la densidad electrónica en las posiciones orto y para , favoreciendo el ataque meta , mientras que el anión libera la densidad electrónica en las mismas posiciones, activándolas para el ataque. [17] Este es precisamente el resultado que predeciría el dibujo de estructuras de resonancia.
Por ejemplo, la anilina tiene estructuras de resonancia con cargas negativas alrededor del sistema de anillos:

El ataque se produce en las posiciones orto y para , porque las cargas negativas formales (parciales) en estas posiciones indican un exceso local de electrones. Por otra parte, las estructuras de resonancia del nitrobenceno tienen cargas positivas alrededor del sistema de anillos:
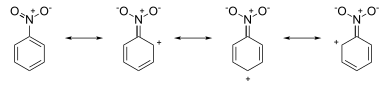
El ataque ocurre en la posición meta , ya que las cargas positivas formales (parciales) en las posiciones orto y para indican deficiencia de electrones en estas posiciones.
Otro argumento común, que hace predicciones idénticas, considera la estabilización o desestabilización por sustituyentes de los intermediarios de Wheland resultantes del ataque electrofílico en las posiciones orto / para o meta . El postulado de Hammond dicta entonces que las energías relativas del estado de transición reflejarán las diferencias en las energías del estado fundamental de los intermediarios de Wheland. [14] [18]
Debido a la carga positiva total o parcial del elemento directamente unido al anillo de cada uno de estos grupos, todos ellos tienen un efecto inductivo de atracción de electrones moderado a fuerte (conocido como efecto -I). También presentan efectos de resonancia de atracción de electrones (conocido como efecto -M):

Por lo tanto, estos grupos hacen que el anillo aromático sea muy pobre en electrones (δ+) en relación con el benceno y, por lo tanto, desactivan fuertemente el anillo (es decir, las reacciones proceden mucho más lentamente en anillos que llevan estos grupos en comparación con las reacciones en el benceno).
Debido a la diferencia de electronegatividad entre el carbono y el oxígeno/nitrógeno, se producirá un ligero efecto de atracción de electrones a través del efecto inductivo (conocido como efecto –I). Sin embargo, el otro efecto llamado resonancia añade densidad electrónica al anillo (conocido como efecto +M) y predomina sobre el efecto inductivo. Por lo tanto, el resultado es que son directores orto / para y directores EDG.
El fenol es un director orto/para, pero en presencia de una base, la reacción es más rápida. Esto se debe a la mayor reactividad del anión fenolato . El oxígeno negativo fue "forzado" a dar densidad electrónica a los carbonos (debido a que tiene una carga negativa, tiene un efecto +I adicional). Incluso cuando está frío y con electrófilos neutros (y relativamente débiles), la reacción todavía ocurre rápidamente.

Los grupos alquilo son grupos donadores de electrones. El carbono en ellos tiene hibridación sp3 y es menos electronegativo que los que tienen hibridación sp2 . Tienen superposición en los enlaces carbono-hidrógeno (o enlaces carbono-carbono en compuestos como el terc -butilbenceno) con el orbital p del anillo. Por lo tanto, son más reactivos que el benceno y son directores orto / para .
Por inducción, el ion carboxilato con carga negativa repele moderadamente los electrones del enlace que lo une al anillo. Por lo tanto, hay un efecto +I donador de electrones débil. Hay un efecto -M casi nulo, ya que la capacidad de resonancia del grupo carbonilo para atraer electrones se elimina de manera efectiva por la deslocalización de la carga negativa del anión en el oxígeno. Por lo tanto, en general, el grupo carboxilato (a diferencia del grupo carboxilo ) tiene una influencia activadora. [10]

Estos grupos tienen un fuerte efecto inductivo de atracción de electrones (-I) ya sea en virtud de su carga positiva o debido a la potente electronegatividad de los halógenos. No hay efecto de resonancia porque no hay orbitales ni pares de electrones que puedan superponerse con los del anillo. El efecto inductivo actúa como el del anión carboxilato pero en la dirección opuesta (es decir, produce pequeñas cargas positivas en las posiciones orto y para pero no en la posición meta y desestabiliza el intermediario de Wheland ). Por lo tanto, estos grupos son desactivadores y directores de meta :

El flúor es una anomalía en estas circunstancias. Arriba, se lo describe como un grupo débil que atrae electrones, pero esto es solo parcialmente cierto. Es correcto que el flúor tiene un efecto -I, que hace que los electrones se atraigan inductivamente. Sin embargo, otro efecto que juega un papel es el efecto +M, que agrega densidad electrónica nuevamente al anillo de benceno (por lo tanto, tiene el efecto opuesto del efecto -I pero por un mecanismo diferente). Esto se llama efecto mesomérico (de ahí +M) y el resultado para el flúor es que el efecto +M aproximadamente cancela el efecto -I. El efecto de esto para el fluorobenceno en la posición para es una reactividad que es comparable a (o incluso mayor que) la del benceno . Debido a que los efectos inductivos dependen en gran medida de la proximidad, las posiciones meta y orto del fluorobenceno son considerablemente menos reactivas que las del benceno. Por lo tanto, la sustitución aromática electrofílica en el fluorobenceno es fuertemente selectiva para .
Este efecto -I y +M es cierto para todos los haluros: cada uno tiene un carácter de atracción y donación de electrones. Para entender por qué se producen los cambios de reactividad, debemos considerar las superposiciones orbitales que se producen en cada uno. Los orbitales de valencia del flúor son los orbitales 2p, que son los mismos para el carbono, por lo tanto, estarán muy cerca en energía y la superposición orbital será favorable. El cloro tiene orbitales de valencia 3p, por lo tanto, las energías orbitales estarán más separadas y la geometría será menos favorable, lo que lleva a una menor donación para estabilizar el intermedio carbocatiónico, por lo que el clorobenceno es menos reactivo que el fluorobenceno . Sin embargo, el bromobenceno y el yodobenceno son aproximadamente iguales o un poco más reactivos que el clorobenceno, porque aunque la donación de resonancia es incluso peor, el efecto inductivo también se debilita debido a sus menores electronegatividades. Por lo tanto, el orden general de reactividad tiene forma de U, con un mínimo en clorobenceno/bromobenceno (tasas de nitración relativas en comparación con el benceno = 1 entre paréntesis): PhF (0,18) > PhCl (0,064) ~ PhBr (0,060) < PhI (0,12). [12] Pero aún así, todos los halobencenos reaccionan más lentamente que el propio benceno.
Observe que el yodobenceno sigue siendo menos reactivo que el fluorobenceno porque la polarizabilidad también juega un papel. Esto también puede explicar por qué el fósforo en los fosfanos no puede donar densidad electrónica al carbono a través de la inducción (es decir, el efecto +I) aunque es menos electronegativo que el carbono (2,19 frente a 2,55, consulte la lista de electronegatividades ) y por qué el ácido yodhídrico ( pKa = -10) es mucho más ácido que el ácido fluorhídrico (pKa = 3). (Eso es 10 13 veces más ácido que el ácido fluorhídrico)
Debido al par solitario de electrones, los grupos halógenos están disponibles para donar electrones, por lo que son directores orto / para .
Debido a la diferencia de electronegatividad entre el carbono y el nitrógeno, el grupo nitroso tiene un efecto -I relativamente fuerte, pero no tan fuerte como el grupo nitro. (Los átomos de nitrógeno con carga positiva en los cationes alquilamonio y en los grupos nitro tienen un efecto -I mucho más fuerte)
El grupo nitroso tiene un efecto +M y -M, pero el efecto -M es más favorable.
El nitrógeno tiene un par solitario de electrones. Sin embargo, el par solitario de su forma monomérica es desfavorable para donar a través de resonancia. Solo la forma dímera está disponible para el efecto +M. Sin embargo, la forma dímera es menos estable en una solución. Por lo tanto, el grupo nitroso está menos disponible para donar electrones.
Por el contrario, es más favorable reducir la densidad electrónica (véase la imagen de la derecha).
.jpg/440px-Nitrosobenzene_resonance_(by_pi_bonds).jpg)
Como resultado, el grupo nitroso es un desactivador. Sin embargo, tiene la capacidad de donar densidad electrónica al anillo de benceno durante el intermedio de Wheland , por lo que sigue siendo un director orto / para .
Hay 2 posiciones orto , 2 posiciones meta y 1 posición para en el benceno cuando un grupo está unido a él. Cuando un grupo es un director orto/para con posiciones orto y para reaccionando con el mismo factor de velocidad parcial, esperaríamos el doble de producto orto que de producto para debido a este efecto estadístico. Sin embargo, los factores de velocidad parcial en las posiciones orto y para no son generalmente iguales. En el caso de un sustituyente de flúor, por ejemplo, el factor de velocidad parcial orto es mucho menor que el para , debido a un efecto de retirada inductiva más fuerte en la posición orto . Aparte de estos efectos, a menudo también hay un efecto estérico , debido al aumento del impedimento estérico en la posición orto pero no en la posición para , lo que lleva a una mayor cantidad del producto para .
El efecto se ilustra para sustituciones aromáticas electrofílicas con sustituyentes de alquilo de diferente demanda estérica para la nitración aromática electrofílica. [19]
El grupo metilo del tolueno es pequeño y hará que el producto orto sea el producto principal. Por otro lado, el grupo t -butilo es muy voluminoso (hay 3 grupos metilo unidos a un solo carbono) y hará que el producto para sea el principal. Incluso con tolueno, el producto no es 2:1, sino que tiene un producto orto ligeramente menor .
Cuando ya hay dos sustituyentes presentes en el anillo, la nueva ubicación del tercer sustituyente es relativamente predecible. Si los sustituyentes existentes se refuerzan o la molécula es muy simétrica, puede que no haya ambigüedad. De lo contrario: [20]




{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )