La química marina , también conocida como química oceánica u oceanografía química , es el estudio de la composición química y los procesos de los océanos del mundo, incluidas las interacciones entre el agua de mar, la atmósfera, el fondo marino y los organismos marinos. [2] Este campo abarca una amplia gama de temas, como el ciclo de elementos como el carbono, el nitrógeno y el fósforo, el comportamiento de los metales traza y el estudio de los gases y nutrientes en entornos marinos. La química marina desempeña un papel crucial en la comprensión de los ciclos biogeoquímicos globales , la circulación oceánica y los efectos de las actividades humanas, como la contaminación y el cambio climático, en los sistemas oceánicos. [2] Está influenciada por la tectónica de placas y la expansión del fondo marino , la turbidez , las corrientes , los sedimentos , los niveles de pH , los componentes atmosféricos, la actividad metamórfica y la ecología.
El impacto de la actividad humana en la composición química de los océanos de la Tierra ha aumentado con el tiempo, y la contaminación procedente de la industria y de diversas prácticas de uso de la tierra ha afectado significativamente a los océanos. Además, el aumento de los niveles de dióxido de carbono en la atmósfera de la Tierra ha provocado la acidificación de los océanos , que tiene efectos negativos en los ecosistemas marinos. La comunidad internacional ha acordado que restaurar la composición química de los océanos es una prioridad, y los esfuerzos encaminados a lograrlo se registran como parte del Objetivo de Desarrollo Sostenible 14 .
Debido a la interrelación del océano, los oceanógrafos químicos trabajan con frecuencia en problemas relacionados con la oceanografía física , la geología y la geoquímica , la biología y la bioquímica , y la ciencia atmosférica . Muchos de ellos están investigando los ciclos biogeoquímicos , y el ciclo del carbono marino en particular atrae un interés significativo debido a su papel en el secuestro de carbono y la acidificación de los océanos . [3] Otros temas importantes de interés incluyen la química analítica de los océanos, la contaminación marina y el cambio climático antropogénico .
La DOM incluye una amplia gama de moléculas orgánicas como aminoácidos, azúcares y lípidos que se disuelven en el agua de mar. Es un componente clave del depósito de carbono del océano, que representa alrededor del 90% del carbono orgánico total en entornos marinos. [4] Se estima que la materia orgánica disuelta coloreada (CDOM) oscila entre el 20 y el 70% del contenido de carbono de los océanos, siendo mayor cerca de las desembocaduras de los ríos y menor en el océano abierto. [5] El ciclo microbiano, un proceso por el cual las bacterias reciclan la DOM en la red alimentaria, es esencial para el ciclo de nutrientes y respalda la productividad primaria en el océano. [6] Los organismos marinos, incluido el fitoplancton, liberan DOM a través de procesos como la excreción, el pastoreo y la descomposición. La DOM también es fundamental para regular el almacenamiento de carbono oceánico, ya que algunas formas son resistentes a la degradación microbiana y pueden permanecer en el océano durante siglos. [7] La vida marina es en gran medida similar en bioquímica a los organismos terrestres, excepto que habitan en un entorno salino. Una consecuencia de su adaptación es que los organismos marinos son la fuente más prolífica de compuestos orgánicos halogenados . [8]
El POM está formado por partículas orgánicas de gran tamaño, como organismos, heces y detritos, que se depositan en la columna de agua. Este material es un componente importante de la bomba biológica, un proceso mediante el cual el carbono se transfiere desde la superficie del océano hasta las profundidades marinas, donde puede almacenarse durante largos períodos. A medida que el POM se hunde, sufre una descomposición por acción de bacterias, lo que libera nutrientes y dióxido de carbono. Una fracción de este material, conocido como POM refractario, puede llegar al fondo del océano y contribuir al secuestro de carbono a largo plazo [9].
El océano es el hogar de una variedad de organismos marinos conocidos como extremófilos , organismos que prosperan en condiciones extremas de temperatura, presión y disponibilidad de luz. Los extremófilos habitan muchos hábitats únicos en el océano, como los respiraderos hidrotermales , las fumarolas negras, las filtraciones frías , las regiones hipersalinas y las bolsas de salmuera del hielo marino . Algunos científicos han especulado que la vida puede haber evolucionado a partir de los respiraderos hidrotermales del océano.
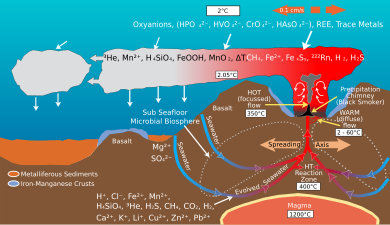
En los respiraderos hidrotermales y entornos similares, muchos extremófilos adquieren energía a través de la quimioautotrofia , utilizando compuestos químicos como fuentes de energía, en lugar de luz como en la fotoautotrofia . Los respiraderos hidrotermales enriquecen el entorno cercano con sustancias químicas como azufre elemental , H 2 , H 2 S , Fe 2+ y metano . Los organismos quimioautotróficos, principalmente procariotas, obtienen energía de estas sustancias químicas a través de reacciones redox . Estos organismos luego sirven como fuentes de alimento para niveles tróficos superiores , formando la base de ecosistemas únicos.
En los ecosistemas de los respiraderos hidrotermales existen varios metabolismos diferentes. Muchos microorganismos marinos, incluidos Thiomicrospira , Halothiobacillus y Beggiatoa , son capaces de oxidar compuestos de azufre, incluido el azufre elemental y el compuesto a menudo tóxico H2S . El H2S es abundante en los respiraderos hidrotermales, y se forma a través de interacciones entre el agua de mar y la roca a las altas temperaturas que se encuentran dentro de los respiraderos. Este compuesto es una fuente importante de energía, que forma la base del ciclo del azufre en los ecosistemas de respiraderos hidrotermales. En las aguas más frías que rodean los respiraderos, la oxidación del azufre puede ocurrir utilizando oxígeno como aceptor de electrones ; más cerca de los respiraderos, los organismos deben utilizar vías metabólicas alternativas o utilizar otro aceptor de electrones, como el nitrato. Algunas especies de Thiomicrospira pueden utilizar tiosulfato como donante de electrones, produciendo azufre elemental. Además, muchos microorganismos marinos son capaces de oxidar el hierro, como Mariprofundus ferrooxydans . La oxidación del hierro puede ser óxica, es decir, que se produce en zonas del océano ricas en oxígeno, o anóxica, es decir, que requiere un aceptor de electrones, como el nitrato, o energía lumínica. En la oxidación del hierro, se utiliza Fe(II) como donante de electrones ; por el contrario, los reductores de hierro utilizan Fe(III) como aceptor de electrones. Estos dos metabolismos forman la base del ciclo redox del hierro y pueden haber contribuido a la formación de hierro bandeado .
En otro extremo, algunos extremófilos marinos habitan en bolsas de salmuera de hielo marino donde la temperatura es muy baja y la salinidad es muy alta. Los organismos atrapados dentro del hielo marino congelado deben adaptarse a un cambio rápido en la salinidad hasta tres veces mayor que la del agua de mar normal, así como al cambio rápido a la salinidad del agua de mar normal cuando el hielo se derrite. La mayoría de los organismos que habitan en bolsas de salmuera son fotosintéticos, por lo tanto, estos microambientes pueden volverse hiperóxicos, lo que puede ser tóxico para sus habitantes. Por lo tanto, estos extremófilos a menudo producen altos niveles de antioxidantes. [10]

La expansión del fondo marino en las dorsales oceánicas es un sistema de intercambio iónico a escala global. [11] Los respiraderos hidrotermales en los centros de expansión introducen diversas cantidades de hierro , azufre , manganeso , silicio y otros elementos en el océano, algunos de los cuales se reciclan en la corteza oceánica . El helio-3 , un isótopo que acompaña al vulcanismo desde el manto, es emitido por los respiraderos hidrotermales y puede detectarse en columnas dentro del océano. [12]
Las tasas de expansión en las dorsales oceánicas varían entre 10 y 200 mm/año. Las tasas de expansión rápidas provocan un aumento de las reacciones del basalto con el agua de mar. La relación magnesio / calcio será menor porque se están eliminando más iones de magnesio del agua de mar y son consumidos por la roca, y se están eliminando más iones de calcio de la roca y se están liberando al agua de mar. La actividad hidrotermal en la cresta de la dorsal es eficiente en la eliminación del magnesio. [13] Una relación Mg/Ca menor favorece la precipitación de polimorfos de carbonato de calcio con bajo contenido de Mg ( mares de calcita ). [11]
La expansión lenta en las dorsales oceánicas tiene el efecto opuesto y dará como resultado una mayor relación Mg/Ca, lo que favorece la precipitación de aragonita y polimorfos de calcita con alto contenido de Mg de carbonato de calcio ( mares de aragonita ). [11]
Los experimentos muestran que la mayoría de los organismos modernos con alto contenido de calcita en Mg habrían sido calcita con bajo contenido de Mg en mares de calcita pasados, [14] lo que significa que la relación Mg/Ca en el esqueleto de un organismo varía con la relación Mg/Ca del agua de mar en la que creció.
De este modo, la mineralogía de los organismos constructores de arrecifes y productores de sedimentos está regulada por reacciones químicas que ocurren a lo largo de la dorsal oceánica, cuya velocidad está controlada por la velocidad de expansión del fondo marino. [13] [14]
La contaminación marina se produce cuando las sustancias utilizadas o difundidas por los seres humanos, como los desechos industriales , agrícolas y residenciales , las partículas , el ruido , el exceso de dióxido de carbono o los organismos invasores, ingresan al océano y causan allí efectos nocivos. La mayoría de estos desechos (80%) provienen de la actividad terrestre, aunque el transporte marítimo también contribuye significativamente. [15] Es una combinación de productos químicos y basura, la mayoría de los cuales provienen de fuentes terrestres y son arrastrados o arrastrados al océano. Esta contaminación produce daños al medio ambiente, a la salud de todos los organismos y a las estructuras económicas en todo el mundo. [16] Dado que la mayoría de los insumos provienen de la tierra, ya sea a través de los ríos , las aguas residuales o la atmósfera, significa que las plataformas continentales son más vulnerables a la contaminación. La contaminación del aire también es un factor contribuyente al arrastrar hierro, ácido carbónico, nitrógeno , silicio, azufre, pesticidas o partículas de polvo al océano. [17] La contaminación a menudo proviene de fuentes no puntuales como la escorrentía agrícola, los escombros arrastrados por el viento y el polvo. Estas fuentes no puntuales se deben en gran medida a la escorrentía que ingresa al océano a través de los ríos, pero los desechos y el polvo arrastrados por el viento también pueden desempeñar un papel, ya que estos contaminantes pueden depositarse en las vías fluviales y los océanos. [18] Las vías de contaminación incluyen la descarga directa, la escorrentía terrestre, la contaminación de los barcos , la contaminación de las sentinas , la contaminación atmosférica y, potencialmente, la minería de aguas profundas .
Los tipos de contaminación marina se pueden agrupar como contaminación por desechos marinos , contaminación plástica , incluidos los microplásticos , acidificación de los océanos , contaminación por nutrientes , toxinas y ruido submarino. La contaminación plástica en el océano es un tipo de contaminación marina por plásticos , que varía en tamaño desde material original de gran tamaño, como botellas y bolsas, hasta microplásticos formados a partir de la fragmentación de material plástico. Los desechos marinos son principalmente basura humana descartada que flota o está suspendida en el océano. La contaminación plástica es dañina para la vida marina .El aumento de los niveles de dióxido de carbono , principalmente debido a la quema de combustibles fósiles , está modificando la química de los océanos. El calentamiento global y los cambios en la salinidad [19] tienen implicaciones significativas para la ecología de los entornos marinos . [20]
La acidificación de los océanos es la disminución continua del pH de los océanos de la Tierra . Entre 1950 y 2020, el pH promedio de la superficie del océano cayó de aproximadamente 8,15 a 8,05. [21] Las emisiones de dióxido de carbono de las actividades humanas son la causa principal de la acidificación de los océanos, con niveles de dióxido de carbono atmosférico (CO 2 ) que superan las 422 ppm (a partir de 2024 [actualizar]). [22] El CO 2 de la atmósfera es absorbido por los océanos. Esta reacción química produce ácido carbónico ( H 2 CO 3 ) que se disocia en un ion bicarbonato ( HCO−3) y un ion hidrógeno ( H + ). La presencia de iones hidrógeno libres ( H + ) reduce el pH del océano, aumentando la acidez (esto no significa que el agua de mar sea ácida todavía; sigue siendo alcalina , con un pH superior a 8). Los organismos marinos calcificantes , como los moluscos y los corales , son especialmente vulnerables porque dependen del carbonato de calcio para construir conchas y esqueletos. [23]
Un cambio de 0,1 en el pH representa un aumento del 26% en la concentración de iones de hidrógeno en los océanos del mundo (la escala de pH es logarítmica, por lo que un cambio de uno en las unidades de pH equivale a un cambio de diez veces en la concentración de iones de hidrógeno). El pH de la superficie del mar y los estados de saturación de carbonatos varían según la profundidad y la ubicación del océano. Las aguas más frías y de latitudes más altas son capaces de absorber más CO 2 . Esto puede hacer que la acidez aumente, reduciendo el pH y los niveles de saturación de carbonatos en estas áreas. Hay varios otros factores que influyen en el intercambio de CO 2 entre la atmósfera y el océano y, por lo tanto, en la acidificación local de los océanos. Estos incluyen las corrientes oceánicas y las zonas de surgencia , la proximidad a grandes ríos continentales, la cobertura de hielo marino y el intercambio atmosférico con nitrógeno y azufre provenientes de la quema de combustibles fósiles y la agricultura . [24] [25] [26]
La desoxigenación de los océanos es la reducción del contenido de oxígeno en diferentes partes del océano debido a las actividades humanas. [28] [29] Hay dos áreas donde esto ocurre. En primer lugar, ocurre en las zonas costeras donde la eutrofización ha provocado algunas disminuciones bastante rápidas (en unas pocas décadas) del oxígeno a niveles muy bajos. [28] Este tipo de desoxigenación de los océanos también se llama zonas muertas . En segundo lugar, la desoxigenación de los océanos también ocurre en el océano abierto. En esa parte del océano, actualmente hay una reducción continua en los niveles de oxígeno. Como resultado, las áreas naturales de bajo oxígeno (las llamadas zonas de mínimo oxígeno (OMZ)) ahora se están expandiendo lentamente. [30] Esta expansión está sucediendo como consecuencia del cambio climático causado por el hombre . [31] [32] La disminución resultante en el contenido de oxígeno de los océanos plantea una amenaza para la vida marina , así como para las personas que dependen de la vida marina para su nutrición o sustento. [33] [34] [35] Una disminución en los niveles de oxígeno del océano afecta la productividad del océano , la forma en que se mueven los nutrientes y el carbono , y el funcionamiento de los hábitats marinos . [36] [37]
A medida que los océanos se calientan, aumenta la pérdida de oxígeno en ellos. Esto se debe a que las temperaturas más cálidas aumentan la estratificación del océano . La razón de esto radica en las múltiples conexiones entre los efectos de densidad y solubilidad que resultan del calentamiento. [38] [39] Como efecto secundario, se reduce la disponibilidad de nutrientes para la vida marina, lo que agrega más estrés a los organismos marinos .
El aumento de las temperaturas en los océanos también provoca una menor solubilidad del oxígeno en el agua, lo que puede explicar aproximadamente el 50% de la pérdida de oxígeno en el nivel superior del océano (>1000 m). El agua oceánica más cálida retiene menos oxígeno y es más flotante que el agua más fría. Esto conduce a una menor mezcla del agua oxigenada cerca de la superficie con el agua más profunda, que naturalmente contiene menos oxígeno. El agua más cálida también aumenta la demanda de oxígeno de los organismos vivos; como resultado, hay menos oxígeno disponible para la vida marina. [40]
Los estudios han demostrado que los océanos ya han perdido entre un 1 y un 2 % de su oxígeno desde mediados del siglo XX [41] [42] y las simulaciones de modelos predicen una disminución de hasta un 7 % en el contenido global de O2 en los océanos durante los próximos cien años. Se proyecta que la disminución del oxígeno continuará durante mil años o más. [43].jpg/440px-HMS_Challenger_(1858).jpg)
Las primeras investigaciones sobre química marina generalmente se centraban en el origen de la salinidad del océano, incluido el trabajo de Robert Boyle . La oceanografía química moderna comenzó como campo con la expedición Challenger de 1872-1876 , liderada por la Marina Real Británica, que realizó las primeras mediciones sistemáticas de la química oceánica. El análisis químico de estas muestras, dirigido por John Murray y George Forchhammer, proporcionó el primer estudio sistemático de la composición del agua de mar, lo que condujo a una mejor comprensión de elementos como el cloruro, el sodio y el sulfato en las aguas oceánicas [44].
A principios del siglo XX se produjeron importantes avances en la química marina, en particular con el desarrollo de técnicas analíticas más precisas. Científicos como Martin Knudsen crearon la Botella Knudsen, un instrumento utilizado para recoger muestras de agua de diferentes profundidades oceánicas. [45] Durante las últimas tres décadas (1970, 19802 y 1990), se realizó una evaluación exhaustiva de los avances en oceanografía química y se recopiló a través de una iniciativa de la National Science Foundation conocida como Futures of Ocean Chemistry in the United States (FOCUS). Este proyecto reunió a numerosos oceanógrafos químicos, químicos marinos y geoquímicos destacados para contribuir al informe FOCUS.
Después de la Segunda Guerra Mundial, los avances en las técnicas geoquímicas impulsaron la química marina hacia una nueva era. Los investigadores comenzaron a utilizar el análisis isotópico para estudiar la circulación oceánica y el ciclo del carbono. Roger Revelle y Hans Suess fueron pioneros en el uso de la datación por radiocarbono para investigar los depósitos de carbono oceánico y su intercambio con la atmósfera. [46]
Desde la década de 1970, el desarrollo de instrumentos altamente sofisticados y modelos computacionales ha revolucionado la química marina. Los científicos ahora pueden medir metales traza , compuestos orgánicos y proporciones isotópicas con una precisión sin precedentes. Los estudios de los ciclos biogeoquímicos marinos, incluidos los ciclos del carbono , el nitrógeno y el azufre , se han vuelto fundamentales para comprender el cambio climático global . El uso de tecnología de teledetección y programas globales de observación de los océanos, como el Programa Internacional de la Geosfera y la Biosfera (IGBP), ha proporcionado datos a gran escala sobre la química de los océanos, lo que permite a los científicos monitorear la acidificación de los océanos , la desoxigenación y otros problemas críticos que afectan el medio marino. [47]
Los oceanógrafos químicos recogen y miden sustancias químicas en el agua de mar, utilizando el conjunto de herramientas estándar de la química analítica , así como instrumentos como medidores de pH , medidores de conductividad eléctrica , fluorómetros y medidores de CO₂ disuelto. La mayoría de los datos se recogen a través de mediciones a bordo y de flotadores o boyas autónomas , pero también se utiliza la teledetección . En un buque de investigación oceanográfica, se utiliza un CTD para medir la conductividad eléctrica , la temperatura y la presión , [48] y a menudo se monta en una roseta de botellas Nansen para recoger agua de mar para su análisis. [49] Los sedimentos se estudian habitualmente con un sacatestigos o una trampa de sedimentos , y los sedimentos más antiguos se pueden recuperar mediante perforaciones científicas .
Se utilizan herramientas analíticas avanzadas como espectrómetros de masas y cromatógrafos para detectar oligoelementos, isótopos y compuestos orgánicos, lo que permite una medición precisa de nutrientes, gases y contaminantes en entornos marinos. [50] En los últimos años, los vehículos submarinos autónomos (AUV) y la tecnología de detección remota han permitido un monitoreo continuo y a gran escala de la química de los océanos, en particular para rastrear los cambios en la acidificación de los océanos y los ciclos de nutrientes. [51]
La química del océano subterráneo de Europa puede ser similar a la de la Tierra. [52] El océano subterráneo de Encélado expulsa hidrógeno y dióxido de carbono al espacio. [53]
Figura 1f