La microbiota pulmonar es la comunidad microbiana pulmonar que consta de una compleja variedad de microorganismos que se encuentran en el tracto respiratorio inferior , particularmente en la capa mucosa y las superficies epiteliales. Estos microorganismos incluyen bacterias , hongos , virus y bacteriófagos . Se ha estudiado más de cerca la parte bacteriana de la microbiota. Consta de un núcleo de nueve géneros : Prevotella , Sphingomonas , Pseudomonas , Acinetobacter , Fusobacterium , Megasphaera , Veillonella , Staphylococcus y Streptococcus . [1] [2] [3] Son bacterias aerobias, anaerobias y aerotolerantes. Las comunidades microbianas son muy variables en individuos particulares y se componen de alrededor de 140 familias distintas. El árbol bronquial, por ejemplo, contiene una media de 2.000 genomas bacterianos por cm 2 de superficie. Las bacterias dañinas o potencialmente dañinas también se detectan de forma rutinaria en muestras respiratorias. Los más importantes son Moraxella catarrhalis , Haemophilus influenzae y Streptococcus pneumoniae . Se sabe que causan trastornos respiratorios en condiciones particulares, es decir, si el sistema inmunológico humano está deteriorado. Se desconoce el mecanismo por el cual persisten en las vías respiratorias inferiores en individuos sanos.
Los géneros de hongos que se encuentran comúnmente conforman el micobioma pulmonar , en la microbiota del pulmón, e incluyen Candida , Malassezia , Neosartorya , Saccharomyces y Aspergillus , entre otros. [4] [5]
El epitelio de las vías respiratorias, junto con los macrófagos alveolares y las células dendríticas, desempeñan un papel importante en el reconocimiento inicial de los productos bacterianos que llegan a las vías respiratorias inferiores con el aire. Dado que algunos de estos productos son potentes estímulos proinflamatorios, es extremadamente importante que el sistema inmunológico distinga entre patógenos y comensales no patógenos. Esto previene el desarrollo de una inflamación constante y genera tolerancia contra la microbiota inofensiva. [6]
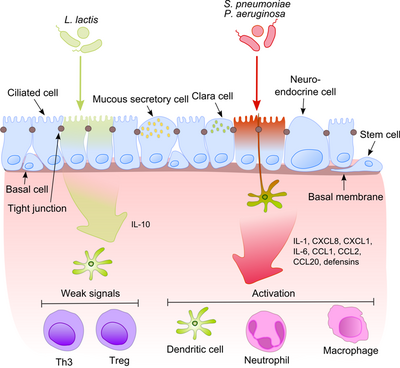
Este proceso se vuelve mucho más intrigante si se tiene en cuenta que los comensales suelen compartir sus moléculas de superficie con patógenos. Las células epiteliales están equipadas con herramientas de reconocimiento muy sensibles: receptores tipo peaje (TLR), receptores tipo dominio de oligomerización de unión a nucleótidos (NOD) (NLR) y receptores tipo gen inducible por ácido retinoico (RIG)-I (RLR) que reconocen una amplia variedad de componentes estructurales microbianos. Después del reconocimiento de las bacterias patógenas, se activan las vías proinflamatorias y se reclutan componentes celulares de la inmunidad adaptativa e innata en el sitio de la infección. [7] Un regulador clave en este proceso es el NF-κB , que se traslada del citoplasma al núcleo y activa genes proinflamatorios en células epiteliales y macrófagos. El complejo proteico de unión al ADN reconoce una secuencia de nucleótidos discreta (5'-GGG ACT TTC T-3') en la región aguas arriba de una variedad de genes de respuesta. La activación de NF-κB por una serie de estímulos: paredes celulares bacterianas o citocinas inflamatorias provoca su translocación al núcleo.
Por el contrario, las bacterias inofensivas no provocan la translocación de NF-κB al núcleo, evitando así la inflamación, aunque pueden expresar los mismos patrones moleculares asociados a microbios (MAMP). Neish sugirió un posible mecanismo que explica este efecto al mostrar que S. typhimurium PhoPc y S. pullorum no patógenos pueden prohibir la ubiquitinación de la molécula inhibidora de NF-κB, el factor nuclear del potenciador del gen del polipéptido ligero NF-κB en el inhibidor de células B. alfa (IκB-κ). [8] Otra explicación de la tolerancia comensal del epitelio se refiere a la modificación postraduccional de una proteína mediante la unión covalente de uno o más monómeros de ubiquitina (Ub). La inhibición de la ubiquitinación conduce a la reducción de la inflamación, porque solo el poliubiquitinado (IκB-κ es el objetivo de la degradación por el proteosoma 26 S, lo que permite la translocación de NF-κB al núcleo y la activación de la transcripción de genes efectores (por ejemplo, IL-8). Las bacterias probióticas como los Lactobacilli son capaces de modular la actividad del sistema Ub-proteosoma mediante la inducción de la producción de especies reactivas de oxígeno (ROS) en las células epiteliales. En las células de mamíferos, se ha demostrado que las ROS sirven como segundos mensajeros críticos en múltiples vías de transducción de señales. La respuesta a las citocinas proinflamatorias inducidas por bacterias causa la inactivación oxidativa del residuo catalítico de cisteína de Ub 12, lo que resulta en una pérdida incompleta pero transitoria de la nedilación de cullina-1 y los consiguientes efectos sobre la señalización de NF-κB y β-catenina. Otra especie comensal, B. thetaiotaomicron . , atenúa la expresión de citoquinas proinflamatorias al promover la exportación nuclear de la subunidad RelA de NF-κB, a través de una vía dependiente del receptor γ activado por el proliferador de peroxisomas (PPAR-γ). PPAR-γ se dirige a Rel A transcripcionalmente activo e induce una eliminación nuclear temprana que limita la duración de la acción de NF-κB.
El equilibrio entre patógenos y comensales es extremadamente importante en el mantenimiento de la homeostasis en el tracto respiratorio.
Las vías respiratorias están continuamente expuestas a multitud de microorganismos, algunos de los cuales son capaces de persistir e incluso colonizar el tracto respiratorio. Esto es posible gracias a la presencia de nutrientes, oxígeno y una temperatura óptima de crecimiento. Existen varias fuentes de nutrientes derivadas del huésped para los microbios residentes: secreciones de las células epiteliales de las vías respiratorias (especialmente células caliciformes), secreciones de las glándulas submucosas y trasudado del plasma. Además, la reserva de nutrientes disponibles aumenta gracias a las actividades de algunos miembros de la microbiota. Los componentes macromoleculares de las secreciones respiratorias (proteínas, glicoproteínas, lípidos, ácidos nucleicos) se convierten en nutrientes (p. ej., carbohidratos, aminoácidos). Así, la actividad metabólica de las bacterias actuales permite la colonización de nuevas especies. Las bacterias comensales no son patógenas y defienden nuestras vías respiratorias contra los patógenos. Hay varios mecanismos posibles. Los comensales son los competidores nativos de las bacterias patógenas, porque tienden a ocupar el mismo nicho ecológico dentro del cuerpo humano. En segundo lugar, son capaces de producir sustancias antibacterianas llamadas bacteriocinas que inhiben el crecimiento de patógenos.
Los géneros Bacillus , Lactobacillus , Lactococcus , Staphylococcus , Streptococcus y Streptomyces son los principales productores de bacteriocinas en el tracto respiratorio. Además, se sabe que los comensales inducen la respuesta Th1 y la producción de interleucina (IL)-10 antiinflamatoria, péptidos antimicrobianos, FOXP3 y producción de inmunoglobulina A secretora (sIgA).

Los cambios en la composición de la comunidad microbiana parecen desempeñar un papel en la progresión de trastornos pulmonares como la enfermedad pulmonar obstructiva crónica (EPOC), el asma y la fibrosis quística . [9] [10] En los seres humanos, S. aureus es parte de la microbiota normal presente en el tracto respiratorio superior, [11] y en la piel y la mucosa intestinal. [12] S. aureus , junto con especies similares que pueden colonizar y actuar simbióticamente pero que pueden causar enfermedades si comienzan a apoderarse de los tejidos que han colonizado o invaden otros tejidos, han sido llamados "patobiontes". [11] MRSA también puede colonizar a las personas sin enfermarlas. [13] La presencia de géneros como Mycoplasma , Pseudomonas y Staphylococcus se correlaciona con un estado estable de EPOC. Por otro lado, Prevotella , Mesorhizobium , Microbacterium , Micrococcus , Veillonela , Rhizobium , Stenotrophomonas y Lactococcus se presentan principalmente en cohortes de individuos sanos. La abundancia relativa de proteobacterias aumenta en los niños asmáticos. Pseudomonas aeruginosa , Staphylococcus aureus y Burkholderia cepacia se encuentran con mayor frecuencia en pacientes con fibrosis quística.
La secuenciación de alto rendimiento y los enfoques de secuenciación del genoma completo proporcionarán más información sobre la complejidad y las implicaciones fisiológicas de las bacterias comensales en el tracto respiratorio inferior.
Figura 2: Distribución de géneros de hongos en diferentes sitios del cuerpo.
{{cite journal}}: Enlace externo en |quote=