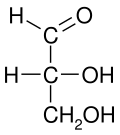

En química , la proyección de Fischer , ideada por Emil Fischer en 1891, es una representación bidimensional de una molécula orgánica tridimensional mediante proyección . Las proyecciones de Fischer se propusieron originalmente para la representación de carbohidratos y fueron utilizadas por químicos, particularmente en química orgánica y bioquímica . Se desaconseja el uso de proyecciones de Fischer en no carbohidratos, ya que dichos dibujos son ambiguos y se confunden fácilmente con otros tipos de dibujos. El propósito principal de las proyecciones de Fischer es mostrar la quiralidad de una molécula y distinguir entre un par de enantiómeros. Algunos usos notables incluyen dibujar azúcares y representar isómeros. [1]
Todos los enlaces se representan como líneas horizontales o verticales. La cadena de carbono se representa verticalmente, con átomos de carbono que a veces no se muestran y se representan por el centro de las líneas cruzadas (ver la figura siguiente). La orientación de la cadena de carbono es tal que el primer carbono (C1) está en la parte superior. [2] En una aldosa , C1 es el carbono del grupo aldehído ; en una cetosa , C1 es el carbono más cercano al grupo cetona , que normalmente se encuentra en C2. [3]
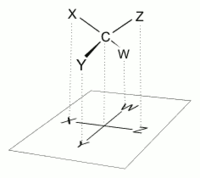
La forma correcta de ver una proyección de Fischer es orientar verticalmente la molécula en relación con la cadena de carbono, hacer que todos los enlaces horizontales apunten hacia el observador y orientar todos los enlaces verticales para que apunten en dirección opuesta al observador. [4] Las moléculas con una geometría tetraédrica simple se pueden rotar fácilmente en el espacio de modo que se cumpla esta condición (ver figuras). Las proyecciones de Fischer se construyen comúnmente comenzando con una representación en caballete. Para ello, todos los enlaces a los carbonos de la cadena principal deben rotarse de modo que las proyecciones de Newman resultantes muestren una configuración eclipsada . [2] Luego, la cadena de carbono se coloca verticalmente hacia arriba con todos los enlaces horizontales apuntando hacia el observador. [2] Finalmente, los enlaces a los carbonos de la cadena principal que miran en dirección opuesta al observador se colocan en la posición vertical de la proyección de Fischer, y los que miran hacia el observador se colocan en la posición horizontal de la proyección de Fischer. [4] Cada intersección entre una línea horizontal y vertical en la proyección de Fischer representa un carbono en la cadena de carbono principal. [2]
Las proyecciones de Fischer son representaciones eficaces de la configuración molecular en 3D en ciertos casos. Por ejemplo, un monosacárido con tres átomos de carbono ( triosa ), como el D- gliceraldehído representado arriba, tiene una geometría tetraédrica, con C2 en su centro, y se puede rotar en el espacio de manera que la cadena de carbono esté vertical con C1 en la parte superior, y los enlaces horizontales que conectan C2 con el hidrógeno y el hidróxido estén inclinados hacia el observador.
Sin embargo, al crear una proyección de Fischer para un monosacárido con más de tres carbonos, no hay forma de orientar la molécula en el espacio de modo que todos los enlaces horizontales estén inclinados hacia el observador. Después de rotar la molécula de modo que ambos enlaces horizontales con C2 estén inclinados hacia el observador, los enlaces horizontales con C3 estarán típicamente inclinados hacia afuera. Por lo tanto, después de dibujar los enlaces con C2, antes de dibujar los enlaces con C3, la molécula debe rotarse en el espacio 180° sobre su eje vertical. Es posible que se necesiten rotaciones similares adicionales para completar el dibujo.
Esto implica que, en la mayoría de los casos, una proyección de Fischer no es una representación precisa de la configuración tridimensional real de una molécula. Puede considerarse como una proyección de una versión modificada de la molécula, idealmente torcida en múltiples niveles a lo largo de su estructura principal. Por ejemplo, una molécula de D- glucosa de cadena abierta rotada de modo que los enlaces horizontales con C2 estén inclinados hacia el observador, tendría los enlaces con C3 y C5 inclinados en dirección contraria al observador y, por lo tanto, su proyección precisa no coincidiría con una proyección de Fischer. Para una representación más precisa de una molécula de cadena abierta , se puede utilizar una proyección de Natta .
De acuerdo con las reglas de la IUPAC, es preferible dibujar explícitamente todos los átomos de hidrógeno; en particular, deben estar presentes los átomos de hidrógeno del grupo final de carbohidratos. [5] En este sentido, la proyección de Fischer es diferente de las fórmulas esqueléticas .
Las moléculas quirales pueden describirse como aquellas con un conjunto de estereoisómeros o enantiómeros levógiros y dextrógiros . Según la definición de Lord Kelvin , una molécula tiene quiralidad "si su imagen en un espejo plano, idealmente realizada, no puede coincidir consigo misma". En otras palabras, una molécula quiral es asimétrica en el sentido de que su imagen especular no será una copia exacta de sí misma. [6] La quiralidad es clave para comprender en muchos campos, como el desarrollo de fármacos, ya que un enantiómero de un fármaco puede causar efectos adversos graves, mientras que el otro proporciona alivio de una dolencia. [7] Esto es significativo en términos de Proyecciones de Fischer, ya que la quiralidad es un factor importante a considerar tanto al dibujarlas como al leerlas. Un gran beneficio del modelo es la capacidad de interpretar la quiralidad con facilidad en función de la orientación de los sustituyentes. Pequeños cambios en el formato de estos modelos pueden hacer que la estereoquímica se interprete de manera diferente, lo que significa que la molécula se ha representado incorrectamente. Las proyecciones de Fischer ayudan a visualizar la quiralidad, así como la orientación de los sustituyentes dentro del espacio, por lo que su aplicación puede ser útil para muchos.
La determinación de la quiralidad basada en las Proyecciones de Fischer es efectivamente la misma que el método estándar. La principal diferencia es el beneficio que proporcionan las Proyecciones de Fischer al representar la orientación de los sustituyentes con las líneas verticales y horizontales. Teniendo en cuenta que la orientación de estas moléculas ya se conoce, se puede representar adecuadamente con cuñas y guiones si es necesario. Después de esto, se clasifica la prioridad de cada uno de los grupos unidos al carbono y se determina la quiralidad de la manera estándar. [8] Si bien no hay una diferencia significativa en el proceso real de determinación de la quiralidad, las Proyecciones de Fischer permiten visualizar mejor dónde están los sustituyentes en el espacio, lo que hace que sea conveniente asignar la quiralidad S o R según este modelo [ dudoso – discutir ] . En ciertos casos, puede ser útil dibujar una Proyección de Fischer a partir de una molécula más grande para visualizar y determinar la quiralidad de un carbono específico.
Las proyecciones de Haworth son una notación química relacionada que se utiliza para representar azúcares en forma de anillo. Los grupos en el lado derecho de una proyección de Fischer son equivalentes a los que están debajo del plano del anillo en las proyecciones de Haworth. [9] Las proyecciones de Fischer no deben confundirse con las estructuras de Lewis , que no contienen ninguna información sobre la geometría tridimensional . Las proyecciones de Newman son otro sistema que se puede utilizar, ya que muestran la estructura de una molécula en los estados de conformación escalonados o eclipsados . [10] La notación de cuña y guión ayudará a mostrar la estereoquímica dentro de una molécula específica.