
El atrapamiento nervioso implica una cascada de cambios fisiológicos causados por la compresión y la tensión. Algunos de estos cambios son irreversibles. [1] La magnitud y duración de las fuerzas determinan la extensión de la lesión. [2] En la forma aguda, la lesión mecánica y los bloqueos metabólicos impiden la función nerviosa. En la forma crónica, hay una secuencia de cambios que comienzan con una ruptura de la barrera hematoencefálica, seguida de edema con cambios en el tejido conectivo, seguido de desmielinización difusa y, finalmente, de axonmetesis. [3] La lesión a menudo será una lesión mixta donde la compresión leve/moderada es una combinación de un bloqueo metabólico y neuropraxia , mientras que la compresión grave combina elementos de neuropraxia y axonmetesis. [4] [2]

Las células nerviosas comprenden un cuerpo celular pequeño y un segmento muy largo llamado axón . El cuerpo celular reside en la médula espinal y el axón se extiende hasta el objetivo de inervación del nervio. Los axones de los nervios periféricos pueden tener más de 100 cm, ya que pueden necesitar viajar a lo largo de toda la longitud de una extremidad para alcanzar su objetivo de inervación, mientras que el cuerpo celular tiene solo 100 micrómetros de largo. [4] Los nervios pueden ser mielinizados o no mielinizados. Los nervios mielinizados tienen el axón cubierto por segmentos de células de Schwann , que son cortas y envuelven concéntricamente el diámetro de un axón para dar la apariencia de una masa similar a una salchicha y se llama vaina de mielina. Las células de Schwann están dispuestas en un patrón de modo que todas las partes del axón están envueltas en células de Schwann y las células de Schwann sucesivas están separadas por una distancia muy pequeña. Este espacio de separación se llama nódulo de Ranvier . [3] Los nervios amielínicos también están rodeados por células de Schwann, pero estas no envuelven el axón varias veces para formar una vaina de mielina.

Los axones de las células nerviosas están rodeados por varias capas de tejido conectivo y agrupados en una estructura llamada fibra nerviosa. En la superficie de una fibra nerviosa hay una capa de tejido llamada epineuro o, a veces, epineuro externo. Dentro del epineuro hay una matriz de tejido conectivo llamada epineuro interno y fascículos . El epineuro interno actúa como un cojín suave para los fascículos. [5] Una fibra nerviosa puede tener un número variable de fascículos, pero habrá al menos uno (de lo contrario, no habría células nerviosas). Los fascículos están rodeados por una capa de tejido llamada perineuro , que es una vaina protectora que actúa como barrera. Dentro de los fascículos se encuentra el endoneuro , una matriz de tejido análoga al epineuro interno, y las células nerviosas. [3] El endoneuro tiene muchos capilares sanguíneos pequeños (microvasos endoneuriales) que irrigan directamente a los propios nervios. Estos capilares tienen uniones estrechas para evitar el libre flujo de materiales entre las células y, en su lugar, requieren que las sustancias pasen a través de las células endoteliales.
La barrera hematoencefálica periférica es análoga a la barrera hematoencefálica. Al igual que la barrera hematoencefálica, la barrera hematoencefálica crea un entorno estable y privilegiado por el que ciertas sustancias no pueden pasar debido a las uniones estrechas. La barrera hematoencefálica está formada por células internas del perineuro y células endoteliales de los microvasos endoneurales . [3]
El atrapamiento de un nervio se produce principalmente por dos fuerzas físicas sobre el tejido blando: la compresión y la tensión. [4] La compresión comprime el nervio y daña su entorno microcirculatorio local, lo que suele ocurrir en los túneles anatómicos. La tensión es una fuerza de tracción, a menudo causada por la cicatrización que impide la movilidad del nervio durante los movimientos de las extremidades. Tanto la magnitud como la duración de estas fuerzas pueden determinar la extensión de la lesión. [2] [3] [6]
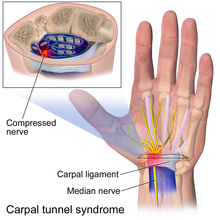
La presión puede interrumpir o detener el entorno microcirculatorio del nervio, lo que da inicio a una cascada fisiopatológica. [4] [2] Cuando el corazón late, impulsa la sangre a través de las arterias, arteriolas y capilares. La sangre también viaja a través de las venas, aunque de manera más pasiva, a través de válvulas y con la ayuda de los músculos para comprimir las venas. Si la presión localizada es lo suficientemente alta, puede interrumpir el flujo normal de sangre.
Para que la compresión afecte la función nerviosa, la presión debe aplicarse de manera no uniforme. Por ejemplo, las ranas pueden sobrevivir en cámaras de presión aisladas a altas presiones, pero una compresión local mucho menor puede bloquear la conducción del nervio. [5] Los buceadores pueden sumergirse a decenas de metros de profundidad y no experimentarán ninguna forma de compresión nerviosa, pero la misma presión que experimentan los buceadores bajo un metro de agua (la presión bajo un m de agua es de 10k Pascal ~ 80 mmHg) aplicada localmente puede detener por completo la función nerviosa. [7]
La compresión es especialmente probable en túneles anatómicos o espacios fibroóseos donde puede haber un conflicto con la cantidad de espacio libre disponible y el volumen del contenido. [2] [1] Si el túnel se estrecha o si el contenido del túnel se expande, habrá un aumento de la presión. Ejemplos de túneles son el túnel carpiano , el túnel tarsiano y el túnel cubital . A veces, la compresión ocurre en áreas que no se consideran túneles y donde un nervio pasa entre dos tipos de tejido mecánicamente más rígidos que pueden apretar o pellizcar el nervio blando. Los ejemplos incluyen el nervio cutáneo femoral lateral en el ligamento inguinal [8] y los nervios cluneales medios en el ligamento sacroilíaco posterior largo . [9] La compresión incluso puede ser dinámica, donde la compresión solo puede estar presente durante ciertas actividades y posiciones. [1] En el síndrome del glúteo profundo , los pacientes a menudo tienen radiculopatía ciática cuando están sentados pero no de pie. [10]
Los estudios sobre la compresión y la función nerviosa han encontrado una relación dosis-respuesta entre la presión y la duración. Es decir, presiones más altas y una duración más larga se asocian con una mayor disfunción. Sin embargo, incluso períodos cortos pero repetidos de compresión también pueden dañar el entorno microcirculatorio de un nervio. La cantidad de presión necesaria para causar disfunción nerviosa comienza alrededor de los 20 mmHg, donde el flujo sanguíneo venoso epineural se reduce. [3] A 30 mmHg, el transporte axonal anterógrado y retrógrado se ve afectado. [3] Entre 30 y 50 mmHg, generalmente habrá cambios en el flujo sanguíneo intraneural, el transporte axonal y la permeabilidad vascular simultáneamente. [4] Y a 80 mmHg, todo el flujo sanguíneo intraneural se detiene, lo que resulta en un bloqueo metabólico completo. [3] La cantidad de presión necesaria para interrumpir el flujo sanguíneo intraneural no es una presión absoluta, sino más bien una función de la presión arterial y la presión de perfusión. [5] Los pacientes con presiones arteriales más altas están algo protegidos de los efectos del atrapamiento nervioso al requerir presiones más altas para interrumpir el flujo sanguíneo intraneural. Si estos mismos pacientes reciben un tratamiento exitoso para su hipertensión, pueden desarrollar síntomas si ya tenían alguna forma latente y subclínica de compresión nerviosa. [3]

Los nervios periféricos se deslizan con frecuencia durante el movimiento de las extremidades. [2] Por ejemplo, el plexo braquial puede moverse hasta 50 mm con la abducción y la aducción del hombro. Los nervios mediano/cubital se mueven 7,3 mm y 9,8 mm durante la flexión y la extensión del codo. El nervio mediano se mueve 9,6 mm con la flexión y la extensión de la muñeca. [2] Este movimiento nervioso también se aplica a los nervios espinales, que pueden estirarse y aflojarse con el movimiento de la columna vertebral. [4] Este deslizamiento nervioso ocurre en los planos tisulares intraneurales y extraneurales. Fuera del nervio, una fina capa de tejido similar a la adventicia rodea el nervio sobre el que se desliza la superficie epineural. Dentro del nervio, los fascículos pueden deslizarse unos contra otros. [2] [3]
La inhibición del deslizamiento normal en estos planos tisulares puede provocar lesiones por estiramiento repetitivo durante los movimientos. Los estudios sobre los nervios ciáticos de conejos han descubierto que incluso un estiramiento agudo del 6 % puede provocar un deterioro significativo con recuperación y un estiramiento agudo del 12 % puede provocar un deterioro completo y ninguna recuperación inmediata. [6] Una única adherencia une el nervio en dos direcciones: entre la raíz espinal y la adherencia y entre la adherencia y las ramas terminales. Estas lesiones provocarán edema y fibrosis, no solo en el nervio sino también en los tejidos circundantes que tocan el nervio, lo que puede inhibir aún más el deslizamiento normal del nervio en un círculo vicioso. [2]
El mecanismo más conocido de alteración del deslizamiento nervioso es la formación de tejido cicatricial que se adhiere a planos de tejido separados. No siempre está claro cómo se forma el tejido cicatricial inicial, pero una vez formado existe un camino claro para la formación de más tejido cicatricial: el movimiento puede causar lesiones por estiramiento en las uniones de tejido blando de la adherencia, lo que desencadena edema y mayor fibrosis del lecho nervioso y potencialmente se extiende dentro del propio nervio. En el síndrome del glúteo profundo, el problema de la cicatriz es la causa más común de atrapamiento del nervio ciático. [11]
La fisiopatología del atrapamiento es compleja porque el tejido nervioso tiene muchos componentes (p. ej., axón, mielina, endoneuro, perineuro, epineuro, vasos sanguíneos, etc.) que pueden responder de manera diferente a diversos factores estresantes que afectan la función nerviosa. [5] El mecanismo subyacente de la lesión generalmente comienza con interrupciones en el suministro vascular. [2] Tanto las formas agudas como crónicas de atrapamiento nervioso implican cambios iniciales en el entorno microcirculatorio. Para el modelo agudo, la secuencia de eventos es típicamente una interrupción del suministro sanguíneo seguida de un bloqueo metabólico a medida que el nervio deja de funcionar. Para el modelo crónico, la secuencia de eventos es una ruptura en la barrera hematoencefálica, seguida de edema endoneural y fibrosis del tejido conectivo, seguida de desmielinización y, finalmente, axonmetesis. [3]
La presión directa puede deformar físicamente la estructura del nervio. La presión local puede crear un desplazamiento bidireccional del tejido nervioso desde el área de compresión al aplastar el tejido comprimido hacia afuera. [4] Los estudios que utilizan un manguito para comprimir un nervio han descubierto que las lesiones más tempranas y graves se producen en el borde del manguito, y esto se denomina "efecto de borde". [2] [3] Se cree que la base física del efecto de borde es un gradiente de presión que deforma y luego lesiona el tejido nervioso, y el gradiente de presión es más alto en los bordes. [4] [5] [2] A nivel microscópico, los vasos sanguíneos intraneurales y las fibras nerviosas se desplazan longitudinalmente por la tensión de corte. [2] Sorprendentemente, las fibras nerviosas más pequeñas son más resistentes a la compresión que las fibras nerviosas grandes. [5]
La función nerviosa depende de su suministro de sangre. Detener o inhibir el suministro de sangre puede privar al tejido nervioso de oxígeno y otros nutrientes esenciales para inducir un bloqueo metabólico, por lo que el nervio es incapaz de funcionar. [4] Este bloqueo es puramente un problema fisiológico tal que la estructura del nervio no cambia. [2] Si el bloqueo metabólico es de corta duración, es completamente reversible sin efectos permanentes. Un ejemplo de un bloqueo metabólico es cuando una extremidad "se queda dormida" (entumecimiento temporal, parestesia y debilidad) debido a la posición de una extremidad que restringe el flujo sanguíneo. La isquemia completa , como la aplicación de un torniquete , es seguida por hiperexcitabilidad y luego pérdida de la función nerviosa durante 60-90 minutos. [4] La isquemia es inmediatamente reversible cuando se libera el bloqueo, siempre que la duración de la isquemia no sea demasiado larga, como 1-2 horas. [2] [4]
El primer signo de alteración del flujo sanguíneo intraneural se produce en los vasos sanguíneos epineurales a una presión de aproximadamente 20-30 mmHg. A presiones de 60-80 mmHg se producirá una isquemia completa. [4] También se puede inducir un bloqueo metabólico mediante estiramiento. En estudios realizados con animales, se observó estasis venosa con un estiramiento del 8 % y con un estiramiento del 15 % el suministro de sangre se detuvo por completo. [4]
Es frecuente que los pacientes que reciben una descompresión nerviosa experimenten una mejoría inmediata de sus síntomas, y se cree que esto se debe a la restauración del flujo sanguíneo después de un bloqueo metabólico, ya que otras formas de deterioro funcional de los nervios, como la neuropraxia y la axonmetesis, tardan más en recuperarse. [4]
Al igual que la compresión aguda, la compresión crónica comienza con el deterioro del entorno microcirculatorio. Los estudios sobre la presión han identificado un "nivel de presión crítico", por encima del cual el nervio se ve afectado significativamente. [5] Este nivel de presión es 30 mmHg inferior a la presión arterial diastólica o 45 mmHg inferior a la sistólica . [12] Curiosamente, los pacientes con presión arterial más alta requieren fuerzas de compresión mayores para interrumpir el entorno microcirculatorio. [5] [2]
Los vasos sanguíneos intraneurales, al igual que otros microvasos del cuerpo humano, aumentan su permeabilidad en respuesta al estrés. [4] Durante períodos prolongados de estrés metabólico, como la isquemia causada por la compresión, la barrera hematoencefálica aumentará su permeabilidad. Este aumento de la permeabilidad en la barrera hematoencefálica es el primer síntoma patológico observado durante los estudios de compresión. [3]
A medida que se rompe la barrera hematoencefálica, las proteínas y las células podrán entrar en el espacio perineural y endoneural. La mayor permeabilidad que permite la entrada de sustancias combinada con la falta de un sistema linfático para drenar los líquidos [2] [4] provoca un aumento de la presión y puede alterar el entorno iónico. [4] El aumento de la presión en el endoneuro puede provocar un mini " síndrome compartimental " que conduce a una isquemia postraumática de las células nerviosas. [4] [5] Cuando se desencadena un edema endoneural , la hinchazón durará muchas horas hasta que se alivie el atrapamiento. Por ejemplo, después de 2 a 8 horas de compresión, la presión del líquido endoneural aumentará rápidamente y puede permanecer elevada durante 24 horas. [2]
Los linfocitos, fibroblastos y macrófagos también podrán atravesar la barrera hematoencefálica permeable y reaccionar a los antígenos contenidos en el espacio perineural, desencadenando una reacción inflamatoria. [3] Como parte de esta reacción inflamatoria, habrá depósitos excesivos de fibrina (es decir, cicatrización). En el análisis histológico , se puede observar fibrosis epineural y engrosamiento perineural. [13] Esta cicatrización es un cambio irreversible asociado con el atrapamiento del nervio. [1] Si la cicatrización daña el entorno microcirculatorio, entonces el suministro de sangre deteriorado también será permanente. En los casos en que existe un deterioro permanente incluso después de una descompresión nerviosa, se cree que la base fisiopatológica se debe a una cicatrización extensa a lo largo y dentro del nervio, ya que la desmielinización y la axonmetesis generalmente son capaces de curar, pero la cicatrización no se puede revertir. [5]
Cuando la compresión nerviosa crónica se vuelve sintomática, es probable que el tejido de mielina en el área de compresión esté dañado, lo que desencadena un proceso llamado desmielinización . Esto solo afecta la vaina de mielina del axón mielinizado, mientras que la continuidad del axón y el nervio permanecerán preservadas. [2] La pérdida de mielina a menudo se ve fácilmente en muestras histológicas, ya que la capa de mielina alrededor de los nervios mielinizados aparecerá muy delgada, lo que representa las últimas etapas de la desmielinización o las primeras etapas de la remielinización. [14]
La patología de un fascículo a otro puede variar. [14] [15] Por ejemplo, en algunos estudios, los fascículos centrales parecían normales, mientras que los fascículos periféricos mostraban un adelgazamiento significativo de la mielina. [15] Incluso dentro de un fascículo, la desmielinización no afecta a los nervios de manera uniforme. Por ejemplo, en las primeras etapas, la desmielinización se puede ver en el borde de los fascículos cerca de la periferia del nervio, y en etapas posteriores la desmielinización se ve de manera difusa dentro de la totalidad de un fascículo. [5] [16]
El daño a la vaina de mielina de los nervios es una lesión nerviosa. Se clasifica como neuropraxia o lesión nerviosa tipo 1 según la clasificación de Sunderland . [2] Puede causar un bloqueo de la conducción local durante semanas o meses mientras las vainas de mielina se regeneran, siempre que no haya una nueva lesión que prolongue la recuperación. [2]
En caso de atrapamiento grave de los nervios, los axones pueden resultar dañados hasta el punto de su destrucción. La lesión axonal también se conoce como axonmetesis o lesión nerviosa tipo Sunderland 2, en la que se preservan los tubos endoneurales. [2] Si se lesiona un axón, el sistema de transporte axonal puede no funcionar. Dado que el axón depende de su conexión con el cuerpo celular, la interrupción del transporte axonal provocará la muerte segmentaria del axón distal al sitio de la lesión en un proceso llamado degeneración walleriana . [4] Esto dará lugar a un bloqueo completo de la conducción, lo que provocará debilidad muscular (nervio motor) o entumecimiento (nervio sensorial). Siempre que no se altere el tubo endoneural, sigue habiendo una vía para que el axón vuelva a crecer en el sitio de la lesión, pero el crecimiento es muy lento (aproximadamente 1 mm/día). [4] La recuperación puede tardar meses y, a menudo, es parcial. [17]
El atrapamiento nervioso es una lesión compleja que afecta a múltiples tipos de tejidos en un fascículo. [5] Puede haber lesiones mixtas en las que las lesiones de tejidos individuales contribuyen a la totalidad de los síntomas. La lesión tisular puede contribuir a los síntomas positivos y/o negativos, que pueden atribuirse a la pérdida de la función nerviosa y la hiperexcitabilidad del tejido nervioso. [4] [2] Además, las fibras nerviosas pueden verse afectadas de forma diferente por la compresión/isquema según su tamaño, ubicación y topografía. [2] Los estudios sobre tejidos humanos no han encontrado una correlación clara entre la cantidad de daño estructural a un nervio y el grado de síntomas. Los pacientes pueden tener síntomas significativos sin cambios en las fibras nerviosas. [14]
Los síntomas negativos son aquellos en los que se pierde la función: debilidad muscular , atrofia , entumecimiento , reflejos disminuidos o ausentes . Estos síntomas representan un bloqueo de la conducción donde las señales nerviosas no pueden transmitirse adecuadamente a lo largo del nervio. Estos síntomas son causados específicamente por bloqueos metabólicos, desmielinización y axonmetesis. Un bloqueo metabólico es la privación temporal de nutrición del suministro de sangre que se revierte fácilmente si la isquemia no dura demasiado. [4] La desmielinización interferirá con la conducción de señales a lo largo del nervio. [4] La axonmetesis dará como resultado un bloqueo de conducción completo ya que la degeneración walleriana destruirá cada parte del axón distal a la lesión si/hasta que el axón vuelva a crecer completamente a su objetivo de inervación más distal.
Los síntomas positivos son aquellos para los que se gana la función: parestesias , aumento de la sensibilidad , dolor , espasmos musculares , fasciculaciones . Los síntomas representan la hiperexcitabilidad de un nervio donde se envía una señal a lo largo de un nervio debido a un umbral más bajo para la activación que resulta en señales espontáneas. La desmielinización puede causar síntomas sensoriales positivos como el dolor debido al aumento de la descarga ectópica. [18] [4] Se ha descubierto que el tejido nervioso desmielinizado tiene un umbral de activación más bajo para enviar una señal, específicamente para la mecanosensibilidad (p. ej., tacto ligero). Si bien existe cierto debate sobre el papel de la sensibilización del sistema nervioso central en las neuropatías por atrapamiento dolorosas, el éxito de los bloqueos nerviosos periféricos sugiere un origen nervioso periférico de este dolor neuropático. [19]
Como la mayoría de los atrapamientos nerviosos no afectan la integridad estructural del endoneuro , perineuro o epineuro , las lesiones nerviosas por atrapamiento nervioso serán principalmente de tipo I o II en la clasificación de Sunderland . Como el atrapamiento nervioso puede dejar nervios individuales en diferentes etapas de lesión, pueden estar presentes lesiones mixtas. Por ejemplo, el atrapamiento leve/moderado puede ver en gran medida una superposición de bloqueo metabólico y lesión de tipo I (daño local de la vaina de mielina). El atrapamiento moderado/grave puede ver lesiones de tipo I y II simultáneamente (daño de la vaina de mielina y daño axonal). [2]
El síndrome de doble aplastamiento es una teoría de lesión nerviosa propuesta por primera vez por Upton y Thomas en 1972. [2] [3] La teoría del doble aplastamiento se considera algo controvertida, ya que existen desacuerdos sobre su existencia y los mecanismos subyacentes que podrían producirla. [20] [21] Postula que la función neuronal se ve afectada porque los axones individuales , habiendo sido comprimidos en un sitio, son susceptibles a una mayor neuropatía debido a una lesión en otro sitio. [22] Esto se debe al deterioro del mecanismo de transporte axonal anterógrado, y con múltiples lesiones que deterioran el transporte axonal anterógrado, el sistema de transporte anterógrado será el más afectado justo distal al atrapamiento más distal. La base de esta teoría fue la alta tasa de radiculopatía cervical observada en pacientes con síndrome del túnel carpiano . [21] [22] Conceptualmente, esto es análogo a múltiples filtros de agua en un sistema de filtración (uno para partículas grandes, uno para bacterias, etc.). El agua estará más limpia justo después del último filtro, pero la filtración se debió a los efectos combinados de los filtros separados. Para desactivar la filtración, se debe quitar cada uno de los filtros en lugar del último filtro.
La estructura de los nervios periféricos incluye un cuerpo celular pequeño en la médula espinal y un axón muy largo que se extiende hasta el objetivo de inervación. Estos nervios miden entre 1 y 1,5 metros (nervio ciático). La mayoría de las sustancias que necesita el axón para sobrevivir se fabrican en el cuerpo celular. [2] La supervivencia del axón depende de su conexión con el cuerpo celular, apoyada por los mecanismos de transporte axonal para transportar material celular. [4] El sistema de transporte axonal transporta material a lo largo del axón en ambas direcciones (anterógrada y retrógrada) a diferentes velocidades (rápida y lenta). [4] [5] El transporte rápido viaja a una velocidad de hasta 400 mm/día. El transporte lento es inferior a 8 mm/día. [23] Durante una compresión no lo suficientemente grave como para causar axonmétesis (no destruir el axón), los axones mantendrán su integridad estructural pero experimentarán una degradación de la función en los sistemas de transporte axonal. Los estudios han demostrado que presiones tan bajas como 30 mmHg pueden perjudicar el transporte axonal. [4] [2]
La teoría del doble aplastamiento originalmente se refería al transporte axonal anterógrado. Por ejemplo, se postuló que una lesión compresiva espinal aumentaba la susceptibilidad a lesiones compresivas más distales como el síndrome del túnel carpiano. Existe una teoría complementaria del doble aplastamiento inverso que se refiere al transporte axonal retrógrado. [5]
La formación extensa de tejido cicatricial es una causa importante de atrapamiento de nervios, y para el síndrome del glúteo profundo (atrapamiento del nervio ciático en el espacio profundo del glúteo), es la causa más común. [11] Si bien el concepto de tejido cicatricial que causa lesiones por tracción es ampliamente aceptado, [2] su papel es más complejo que causar estrictamente lesiones por estiramiento. El tejido cicatricial en sí es muy denso y es capaz de aplicar presión sobre un nervio a través de bandas (como un cinturón de seguridad) [24] o crear un túnel fibroso que es capaz de pellizcar el nervio bajo presión debido a su dureza. [1] En casos avanzados, se puede encontrar tejido cicatricial en todas las capas del nervio, lo que afecta el flujo sanguíneo y las funciones esenciales de varios tipos de tejido. [5] Esto quiere decir que el tejido cicatricial es bastante robusto en su capacidad de lesionar los nervios. Puede hacerlo a través de tracción (accesorios fibrovasculares), compresión (túneles osteofibrosos) o puede estar asociado con una respuesta inflamatoria que lesiona el tejido (fibrosis).