Un oxianión , u oxoanión , es un ion con la fórmula genérica A
incógnitaOhz -
y(donde A representa un elemento químico y O representa un átomo de oxígeno ). Los oxianiones están formados por una gran mayoría de los elementos químicos . [1] Las fórmulas de los oxianiones simples se determinan mediante la regla del octeto . El oxiácido correspondiente de un oxianión es el compuesto H
elA
incógnitaOh
yLas estructuras de los oxianiones condensados se pueden racionalizar en términos de unidades poliédricas AO n con vértices o aristas compartidas entre poliedros. Los oxianiones (específicamente, los ésteres de fosfato y polifosfato) adenosina monofosfato ( AMP ), adenosina difosfato ( ADP ) y adenosina trifosfato (ATP) son importantes en biología.
La fórmula de los oxianiones monoméricos , AOm -
n, está determinado por el estado de oxidación del elemento A y su posición en la tabla periódica . Los elementos de la primera fila están limitados a un número de coordinación máximo de 4. Sin embargo, ninguno de los elementos de la primera fila tiene un oxianión monomérico con ese número de coordinación. En cambio, el carbonato ( CO2−
3) y nitrato ( NO−
3) tienen una estructura plana trigonal con enlaces π entre el átomo central y los átomos de oxígeno. Este enlace π se ve favorecido por la similitud de tamaño entre el átomo central y el oxígeno.
Los oxianiones de los elementos de la segunda fila en el estado de oxidación del grupo son tetraédricos . Las unidades tetraédricas de SiO 4 se encuentran en los minerales de olivino , (Mg,Fe) 2 SiO 4 , pero el anión no tiene una existencia separada ya que los átomos de oxígeno están rodeados tetraédricamente por cationes en el estado sólido. Fosfato ( PO3−
4), sulfato ( SO2−
4) y perclorato ( ClO−
4) Los iones se pueden encontrar como tales en varias sales. Muchos oxianiones de elementos en estado de oxidación inferior obedecen a la regla del octeto y esto se puede utilizar para racionalizar las fórmulas adoptadas. Por ejemplo, el cloro(V) tiene dos electrones de valencia, por lo que puede acomodar tres pares de electrones de enlaces con iones de óxido. La carga del ion es +5 − 3 × 2 = −1, por lo que la fórmula es ClO−
3La teoría VSEPR predice que la estructura del ion es piramidal, con tres pares de electrones enlazantes y un par solitario. De manera similar, el oxianión del cloro(III) tiene la fórmula ClO−
2, y está doblado con dos pares solitarios y dos pares de enlace.
En la tercera fila y las siguientes de la tabla periódica, es posible la coordinación 6, pero no se conocen oxianiones octaédricos aislados porque tendrían una carga eléctrica demasiado alta. Por lo tanto, el molibdeno (VI) no forma MoO6−
6, pero forma el anión molibdato tetraédrico, MoO2−
4Las unidades de MoO 6 se encuentran en molibdatos condensados. Los oxianiones completamente protonados con una estructura octaédrica se encuentran en especies como Sn(OH)2−
6y Sb(OH)−
6Además, el ortoperyodato sólo puede desprotonarse parcialmente, [Nota 1] con
La denominación de los oxianiones monoméricos sigue las siguientes reglas.
Aquí el grupo de los halógenos (grupo 7 A, 17) se denomina grupo VII y el grupo de los gases nobles (grupo 8 A) se denomina grupo VIII.
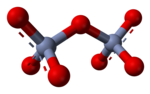
En solución acuosa, los oxianiones con alta carga pueden sufrir reacciones de condensación, como en la formación del ion dicromato , Cr 2 O2−7:
La fuerza impulsora de esta reacción es la reducción de la densidad de carga eléctrica del anión y la eliminación del ion hidronio ( H + ). La cantidad de orden en la solución disminuye, liberando una cierta cantidad de entropía que hace que la energía libre de Gibbs sea más negativa y favorece la reacción directa. Es un ejemplo de una reacción ácido-base con el oxianión monomérico actuando como base y el oxianión condensado actuando como su ácido conjugado . La reacción inversa es una reacción de hidrólisis , ya que una molécula de agua , que actúa como base, se divide. Puede ocurrir una condensación adicional, particularmente con aniones de mayor carga, como ocurre con los fosfatos de adenosina.
La conversión de ATP en ADP es una reacción de hidrólisis y es una fuente importante de energía en los sistemas biológicos.
La formación de la mayoría de los minerales de silicato puede considerarse como el resultado de una reacción de descondensación en la que la sílice reacciona con un óxido básico, una reacción ácido-base en el sentido Lux-Flood .

Un polioxianión es un oxianión polimérico en el que múltiples monómeros de oxianiones, generalmente considerados poliedros MO n , se unen compartiendo esquinas o aristas. [4] Cuando se comparten dos esquinas de un poliedro, la estructura resultante puede ser una cadena o un anillo. Las cadenas cortas se dan, por ejemplo, en los polifosfatos . Los inosilicatos, como los piroxenos , tienen una cadena larga de tetraedros de SiO 4 , cada uno de los cuales comparte dos esquinas. La misma estructura se da en los denominados metavanadatos, como el metavanadato de amonio , NH 4 VO 3 .
La fórmula del oxianión SiO2−3se obtiene de la siguiente manera: cada ion de silicio nominal ( Si 4+ ) está unido a dos iones de óxido nominales ( O 2− ) y tiene una participación de la mitad en otros dos. Por lo tanto, la estequiometría y la carga vienen dadas por:
Un anillo puede verse como una cadena en la que se han unido los dos extremos. Trifosfato cíclico , P 3 O3−9es un ejemplo
Cuando se comparten tres esquinas, la estructura se extiende a dos dimensiones. En los anfíboles (de los cuales el asbesto es un ejemplo), dos cadenas están unidas entre sí al compartir una tercera esquina en lugares alternos a lo largo de la cadena. Esto da como resultado una fórmula ideal Si 4 O6−11y una estructura de cadena lineal que explica la naturaleza fibrosa de estos minerales. Compartir los tres vértices puede dar como resultado una estructura en láminas, como en la mica , Si 2 O2−5, en el que cada silicio tiene un oxígeno propio y la mitad de otros tres. La mica cristalina se puede dividir en láminas muy delgadas.
La puesta en común de los cuatro vértices de los tetraedros da como resultado una estructura tridimensional, como la del cuarzo . Los aluminosilicatos son minerales en los que una parte del silicio se sustituye por aluminio. Sin embargo, el estado de oxidación del aluminio es uno menor que el del silicio, por lo que la sustitución debe ir acompañada de la adición de otro catión. El número de combinaciones posibles de una estructura de este tipo es muy grande, lo que, en parte, explica por qué existen tantos aluminosilicatos.
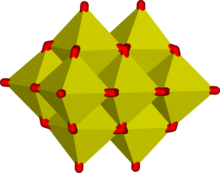
Las unidades octaédricas MO 6 son comunes en los oxianiones de los metales de transición más grandes. Algunos compuestos, como las sales del ion polimérico de cadena, Mo 2 O2−7Incluso contienen unidades tetraédricas y octaédricas. [5] [6] La compartición de aristas es común en iones que contienen bloques de construcción octaédricos y los octaedros suelen estar distorsionados para reducir la tensión en los átomos de oxígeno puente. Esto da como resultado estructuras tridimensionales llamadas polioxometalatos . Ejemplos típicos ocurren en la estructura de Keggin del ion fosfomolibdato . La compartición de aristas es un medio eficaz para reducir la densidad de carga eléctrica, como se puede ver con la reacción de condensación hipotética que involucra dos octaedros:
Aquí, la carga promedio de cada átomo de M se reduce en 2. La eficacia de compartir los bordes se demuestra mediante la siguiente reacción, que ocurre cuando se acidifica una solución acuosa alcalina de molibdato.
El ion molibdato tetraédrico se convierte en un grupo de 7 octaedros unidos por los bordes [6] [7], lo que da una carga promedio en cada molibdeno de 6 ⁄ 7 . El grupo de heptamolibdato es tan estable que no se han detectado grupos con entre 2 y 6 unidades de molibdato, aunque deben formarse como intermediarios.
El pKa de los ácidos relacionados se puede calcular a partir del número de enlaces dobles con el oxígeno. Por tanto, el ácido perclórico es un ácido muy fuerte, mientras que el ácido hipocloroso es muy débil. Una regla sencilla suele funcionar con un margen de error de aproximadamente 1 unidad de pH.
La mayoría de los oxianiones son bases débiles y pueden protonarse para formar ácidos o sales de ácidos. Por ejemplo, el ion fosfato puede protonarse sucesivamente para formar ácido fosfórico.


El grado de protonación en solución acuosa dependerá de las constantes de disociación ácida y del pH . Por ejemplo, el AMP (adenosín monofosfato) tiene un valor de p K de 6,21, [8] por lo que a pH 7 estará protonado en un 10 %. La neutralización de la carga es un factor importante en estas reacciones de protonación. Por el contrario, los aniones univalentes, los iones perclorato y permanganato, son muy difíciles de protonar y, por lo tanto, los ácidos correspondientes son ácidos fuertes .
Aunque los ácidos como el ácido fosfórico se escriben como H 3 PO 4 , los protones están unidos a átomos de oxígeno formando grupos hidroxilo, por lo que la fórmula también se puede escribir como OP(OH) 3 para reflejar mejor la estructura. El ácido sulfúrico se puede escribir como O 2 S(OH) 2 ; esta es la molécula que se observa en la fase gaseosa.
El ion fosfito , PO3−3, es una base fuerte y por lo tanto siempre lleva al menos un protón. En este caso el protón está unido directamente al átomo de fósforo con la estructura HPO2−3Al formar este ion, el ion fosfito se comporta como una base de Lewis y dona un par de electrones al ácido de Lewis, H + .

Como se mencionó anteriormente, una reacción de condensación también es una reacción ácido-base. En muchos sistemas, pueden ocurrir reacciones tanto de protonación como de condensación. El caso del ion cromato proporciona un ejemplo relativamente simple. En el diagrama de predominio del cromato, que se muestra a la derecha, pCr representa el logaritmo negativo de la concentración de cromo y pH representa el logaritmo negativo de la concentración del ion H + . Hay dos equilibrios independientes. Las constantes de equilibrio se definen de la siguiente manera. [9]
El diagrama de predominio se interpreta de la siguiente manera.
Las especies H 2 CrO 4 y HCr 2 O−7No se muestran porque se forman solo a un pH muy bajo.
Los diagramas de predominancia pueden volverse muy complicados cuando se pueden formar muchas especies poliméricas, [10] como en los vanadatos , molibdatos y tungstatos . Otra complicación es que muchos de los polímeros superiores se forman con extrema lentitud, de modo que el equilibrio puede no alcanzarse ni siquiera en meses, lo que conduce a posibles errores en las constantes de equilibrio y en el diagrama de predominancia.
{{cite book}}: CS1 maint: multiple names: authors list (link)