La deposición electroforética ( EPD ) es un término que designa una amplia gama de procesos industriales que incluyen el electrorrecubrimiento , la electrodeposición catódica , la electrodeposición anódica y el recubrimiento electroforético o pintura electroforética . Una característica característica de este proceso es que las partículas coloidales suspendidas en un medio líquido migran bajo la influencia de un campo eléctrico ( electroforesis ) y se depositan sobre un electrodo . Todas las partículas coloidales que se pueden utilizar para formar suspensiones estables y que pueden transportar una carga se pueden utilizar en la deposición electroforética. Esto incluye materiales como polímeros , pigmentos , colorantes , cerámicas y metales .
El proceso es útil para aplicar materiales a cualquier superficie conductora de electricidad . Los materiales que se depositan son el factor determinante principal de las condiciones de procesamiento reales y del equipo que se puede utilizar.
Debido a la amplia utilización de procesos de pintura electroforética en muchas industrias, el EPD acuoso es el proceso de EPD comercialmente más común. Sin embargo, se conocen aplicaciones de deposición electroforética no acuosa. Actualmente se están explorando aplicaciones de EPD no acuosa para su uso en la fabricación de componentes electrónicos y la producción de recubrimientos cerámicos . Los procesos no acuosos tienen la ventaja de evitar la electrólisis del agua y la evolución de oxígeno que acompaña a la electrólisis.
Este proceso se utiliza industrialmente para aplicar revestimientos a productos fabricados con metal. Se ha utilizado ampliamente para recubrir carrocerías y piezas de automóviles, tractores y equipos pesados, interruptores eléctricos, electrodomésticos, muebles de metal, contenedores de bebidas, sujetadores y muchos otros productos industriales.
Los procesos de EPD se aplican a menudo para la fabricación de fotocatalizadores de dióxido de titanio (TiO 2 ) soportados para aplicaciones de purificación de agua, utilizando polvos precursores que se pueden inmovilizar mediante métodos de EPD sobre diversos materiales de soporte. Las películas gruesas producidas de esta manera permiten una síntesis más barata y rápida en relación con las películas delgadas de sol-gel , junto con niveles más altos de área de superficie del fotocatalizador.
En la fabricación de celdas de combustible de óxido sólido, las técnicas EPD se emplean ampliamente para la fabricación de ánodos de ZrO2 porosos a partir de precursores en polvo sobre sustratos conductores.
Los procesos de EPD tienen una serie de ventajas que han hecho que dichos métodos sean ampliamente utilizados [1]
En varios laboratorios de investigación se han fabricado piezas cerámicas complejas y de gran espesor. Además, se ha utilizado EPD para producir microestructuras personalizadas , como gradientes funcionales y laminados, mediante el control de la suspensión durante el procesamiento. [2]
La primera patente para el uso de la pintura electroforética se concedió en 1917 a Davey y General Electric . Desde la década de 1920, el proceso se ha utilizado para la deposición de látex de caucho . En la década de 1930 se concedieron las primeras patentes que describían resinas dispersables en agua y neutralizadas con base, diseñadas específicamente para EPD.
El recubrimiento electroforético comenzó a tomar su forma actual a fines de la década de 1950, cuando el Dr. George EF Brewer y el equipo de Ford Motor Company comenzaron a trabajar en el desarrollo del proceso para el recubrimiento de automóviles. El primer sistema anódico comercial para automóviles comenzó a funcionar en 1963.
La primera patente para un producto de EPD catódico se emitió en 1965 y se asignó a BASF AG . PPG Industries, Inc. fue la primera en introducir comercialmente el EPD catódico en 1970. El primer uso de EPD catódico en la industria automotriz fue en 1975. Hoy en día, alrededor del 70% del volumen de EPD en uso en el mundo es del tipo EPD catódico, en gran parte debido al alto uso de la tecnología en la industria automotriz. Es probablemente el mejor sistema jamás desarrollado y ha dado como resultado una gran extensión de la vida útil de la carrocería en la industria automotriz.
Existen miles de patentes que se han expedido relacionadas con diversas composiciones de EPD, procesos de EPD y artículos recubiertos con EPD. Aunque varias oficinas de patentes gubernamentales han expedido patentes, prácticamente todos los avances importantes se pueden seguir revisando las patentes expedidas por la Oficina de Patentes y Marcas de los Estados Unidos .
El proceso industrial general de deposición electroforética consta de varios subprocesos:
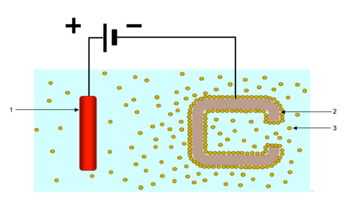
Durante el proceso de EPD, se aplica corriente continua a una solución de polímeros con grupos ionizables o a una suspensión coloidal de polímeros con grupos ionizables que también pueden incorporar materiales sólidos como pigmentos y cargas. Los grupos ionizables incorporados al polímero se forman mediante la reacción de un ácido y una base para formar una sal . La carga particular, positiva o negativa, que se imparte al polímero depende de la naturaleza química del grupo ionizable. Si los grupos ionizables del polímero son ácidos, el polímero tendrá una carga negativa cuando se le agregue una sal a la solución. Si los grupos ionizables del polímero son bases, el polímero tendrá una carga positiva cuando se le agregue una sal a la solución con un ácido.
Existen dos tipos de procesos de EPD: anódico y catódico. En el proceso anódico, el material cargado negativamente se deposita sobre el electrodo cargado positivamente, o ánodo . En el proceso catódico, el material cargado positivamente se deposita sobre el electrodo cargado negativamente, o cátodo . [3]
Cuando se aplica un campo eléctrico, todas las especies cargadas migran por el proceso de electroforesis hacia el electrodo con la carga opuesta. Existen varios mecanismos por los cuales se puede depositar material sobre el electrodo:
El proceso electroquímico principal que ocurre durante la electrodeposición acuosa es la electrólisis del agua. Esto se puede demostrar mediante las dos semirreacciones siguientes que ocurren en los dos electrodos:
En la deposición anódica, el material que se deposita tendrá sales de un ácido como grupo portador de carga. Estos aniones con carga negativa reaccionan con los iones de hidrógeno con carga positiva (protones) que se producen en el ánodo mediante la electrólisis del agua para reformar el ácido original. El ácido completamente protonado no lleva carga (destrucción de carga) y es menos soluble en agua, y puede precipitarse del agua sobre el ánodo.
La situación análoga ocurre en la deposición catódica, excepto que el material que se deposita tendrá sales de una base como grupo portador de carga. Si la sal de la base se ha formado por protonación de la base, la base protonada reaccionará con los iones hidroxilo que se forman por electrólisis del agua para producir la base cargada neutra (nuevamente destrucción de carga) y agua. El polímero sin carga es menos soluble en agua de lo que era cuando estaba cargado y se produce la precipitación en el cátodo.
Las sales de onio, que se han utilizado en el proceso catódico, no son bases protonadas y no se depositan por el mecanismo de destrucción de carga. Este tipo de materiales se pueden depositar en el cátodo por coagulación por concentración y desoxidación. A medida que las partículas coloidales alcanzan el objeto sólido que se va a recubrir, se comprimen entre sí y el agua de los intersticios se expulsa. A medida que se comprimen las micelas individuales , se colapsan para formar micelas cada vez más grandes. La estabilidad coloidal es inversamente proporcional al tamaño de la micela, por lo que a medida que las micelas se hacen más grandes, se vuelven cada vez menos estables hasta que precipitan de la solución sobre el objeto que se va a recubrir. A medida que se concentran más y más grupos cargados en un volumen menor, esto aumenta la fuerza iónica del medio, lo que también ayuda a precipitar los materiales fuera de la solución. Ambos procesos ocurren simultáneamente y ambos contribuyen a la deposición de material.
Durante el proceso de deposición acuosa, se forma gas en ambos electrodos. Se forma gas hidrógeno en el cátodo y gas oxígeno en el ánodo . Para una cantidad dada de transferencia de carga, se genera exactamente el doble de hidrógeno en comparación con el oxígeno a nivel molecular.
Esto tiene algunos efectos significativos en el proceso de recubrimiento. El más obvio es el aspecto de la película depositada antes del proceso de horneado. El proceso catódico da como resultado una cantidad considerablemente mayor de gas atrapado dentro de la película que el proceso anódico. Dado que el gas tiene una resistencia eléctrica mayor que la película de depósito o el baño en sí, la cantidad de gas tiene un efecto significativo en la corriente a un voltaje aplicado determinado . Por eso, los procesos catódicos a menudo pueden funcionar a voltajes significativamente más altos que los procesos anódicos correspondientes.
El recubrimiento depositado tiene una resistencia significativamente mayor que el objeto que se está recubriendo. A medida que la película depositada se precipita, la resistencia aumenta. El aumento de la resistencia es proporcional al espesor de la película depositada y, por lo tanto, a un voltaje determinado, la corriente eléctrica disminuye a medida que la película se vuelve más gruesa hasta que finalmente llega a un punto en el que la deposición se ralentiza o deja de producirse (autolimitación). Por lo tanto, el voltaje aplicado es el control principal de la cantidad de película aplicada.
La capacidad del recubrimiento EPD para recubrir los huecos interiores de una pieza se denomina "poder de penetración". En muchas aplicaciones, es deseable utilizar materiales de recubrimiento con un alto poder de penetración. El poder de penetración de un recubrimiento depende de una serie de variables, pero en general, se puede afirmar que cuanto mayor sea el voltaje de recubrimiento, más lejos se "expulsará" un recubrimiento determinado hacia los huecos. Las pinturas electroforéticas de alto poder de penetración suelen utilizar voltajes de aplicación superiores a los 300 voltios de CC.
La temperatura del recubrimiento también es una variable importante que afecta el proceso de EPD. La temperatura del recubrimiento tiene un efecto sobre la conductividad del baño y la conductividad de la película depositada, que aumenta a medida que aumenta la temperatura. La temperatura también tiene un efecto sobre la viscosidad de la película depositada, que a su vez afecta la capacidad de la película depositada para liberar las burbujas de gas que se están formando.
La temperatura de coalescencia del sistema de recubrimiento también es una variable importante para el diseñador del recubrimiento. Se puede determinar trazando la formación de película de un sistema determinado en función de la temperatura de recubrimiento, manteniendo constante el tiempo de recubrimiento y el perfil de aplicación de voltaje. A temperaturas inferiores a la temperatura de coalescencia, el comportamiento de crecimiento de la película y el comportamiento de ruptura son bastante diferentes de lo habitual como resultado de la deposición porosa.
El tiempo de recubrimiento también es una variable importante para determinar el espesor de la película, la calidad de la película depositada y el poder de penetración. Según el tipo de objeto que se esté recubriendo, pueden ser adecuados tiempos de recubrimiento de varios segundos a varios minutos.
El voltaje máximo que se puede utilizar depende del tipo de sistema de recubrimiento y de otros factores. Como ya se ha indicado, el espesor de la película y la potencia de penetración dependen del voltaje de aplicación. Sin embargo, con voltajes excesivamente altos, puede producirse un fenómeno denominado "ruptura". El voltaje en el que se produce este fenómeno se denomina "voltaje de ruptura". El resultado de la ruptura es una película que suele ser muy gruesa y porosa. Normalmente, no es una película aceptable desde el punto de vista estético ni funcional. Las causas y los mecanismos de la ruptura no se comprenden por completo, sin embargo, se sabe lo siguiente:
Existen dos categorías principales de procesos químicos de EPD: anódico y catódico. Ambos siguen utilizándose comercialmente, aunque el proceso anódico se ha utilizado industrialmente durante un período de tiempo más largo y, por lo tanto, se considera el más antiguo de los dos. Ambos tipos de procesos tienen ventajas y desventajas, y diferentes expertos pueden tener diferentes perspectivas sobre algunos de los pros y contras de cada uno.
Las principales ventajas que normalmente se promocionan para el proceso anódico son:
Las principales ventajas que normalmente se promocionan para los procesos catódicos son:
Una diferencia significativa y real que no se menciona a menudo es el hecho de que las tecnologías de reticulación catalizada por ácido son más apropiadas para el proceso anódico. Dichos reticulantes se utilizan ampliamente en todo tipo de aplicaciones de revestimiento. Entre ellos se incluyen reticulantes populares y relativamente económicos como los reticulantes de melamina - formaldehído , fenol -formaldehído, urea-formaldehído y acrilamida -formaldehído.
Los reticulantes de tipo melamina-formaldehído, en particular, se utilizan ampliamente en los recubrimientos electrolíticos anódicos. Estos tipos de reticulantes son relativamente económicos y ofrecen una amplia gama de características de curado y rendimiento que permiten al diseñador del recubrimiento adaptar el producto al uso final deseado. Los recubrimientos formulados con este tipo de reticulante pueden tener una resistencia aceptable a la luz ultravioleta. Muchos de ellos son materiales de viscosidad relativamente baja y pueden actuar como plastificantes reactivos, reemplazando parte del disolvente orgánico que de otro modo podría ser necesario. La cantidad de formaldehído libre, así como el formaldehído que puede liberarse durante el proceso de horneado, es motivo de preocupación, ya que se consideran contaminantes atmosféricos peligrosos.
La película depositada en los sistemas catódicos es bastante alcalina y, en general, no se han preferido las tecnologías de reticulación catalizada por ácidos en los productos catódicos, aunque ha habido algunas excepciones. El tipo de química de reticulación más común que se utiliza actualmente en los productos catódicos se basa en la química del uretano y la urea.
El reticulante de tipo urea y poliuretano aromático es una de las razones importantes por las que muchos recubrimientos electrolíticos catódicos muestran altos niveles de protección contra la corrosión. Por supuesto, no es la única razón, pero si se comparan las composiciones de recubrimiento electrolítico con reticulantes de uretano aromático con sistemas análogos que contienen reticulantes de uretano alifático, los sistemas con reticulantes de uretano aromático funcionan de manera consistente significativamente mejor. Sin embargo, los recubrimientos que contienen reticulantes de uretano aromático generalmente no funcionan bien en términos de resistencia a la luz ultravioleta. Si el recubrimiento resultante contiene reticulantes de urea aromática, la resistencia a la luz ultravioleta será considerablemente peor que si solo pueden producirse reticulaciones de uretano. Una desventaja de los uretanos aromáticos es que también pueden causar amarilleamiento del propio recubrimiento, así como causar amarilleamiento en las capas de capa superior posteriores. Una reacción secundaria no deseada significativa que ocurre durante el proceso de horneado produce poliaminas aromáticas . Se puede esperar que los reticulantes de uretano basados en diisocianato de tolueno (TDI) produzcan diamina de tolueno como reacción secundaria, mientras que los basados en diisocianato de metileno difenilo producen diaminodifenilmetano y poliaminas aromáticas de orden superior. Las poliaminas aromáticas no deseadas pueden inhibir el curado de las capas de acabado catalizadas por ácido posteriores y pueden causar delaminación de las capas de acabado posteriores después de la exposición a la luz solar. Aunque la industria nunca ha reconocido este problema, muchas de estas poliaminas aromáticas no deseadas son carcinógenas conocidas o sospechadas.
Además de las dos categorías principales de anódicos y catódicos, los productos EPD también se pueden describir por la química del polímero base que se utiliza. Hay varios tipos de polímeros que se han utilizado comercialmente. Muchos de los primeros tipos anódicos se basaban en aceites maleinizados de varios tipos, siendo el aceite de resina y el aceite de linaza dos de los más comunes. Hoy en día, predominan los tipos epoxi y acrílicos. La descripción y las ventajas generalmente promocionadas son las siguientes:
La velocidad de deposición electroforética (EPD) depende de múltiples procesos cinéticos diferentes que actúan en conjunto. Uno de los principales procesos cinéticos involucrados en la EPD es la electroforesis, el movimiento de partículas cargadas en respuesta a un campo eléctrico. Pero a medida que la concentración local de partículas disminuye cerca de los electrodos, la difusión de partículas desde áreas de alta concentración a áreas de baja concentración, impulsada por una diferencia en el potencial químico, también influirá en la velocidad de deposición. En esta sección se analizarán las condiciones que determinan las velocidades de cada uno de estos procesos y cómo se incorporan esas variables en diferentes modelos utilizados para evaluar la EPD.
Para que se produzca cualquiera de estos procesos, las moléculas deben formar una suspensión acuosa estable. Existen cuatro procesos comunes mediante los cuales la partícula puede obtener la carga superficial necesaria para formar una dispersión estable: 1. Disociación o ionización de un grupo superficial 2. Reabsorción de iones 3. Adsorción de surfactantes ionizados 4. Sustitución isomórfica. La química de la superficie de la molécula y su entorno local determinarán cómo obtiene una carga superficial. Sin una carga superficial suficiente para equilibrar las fuerzas de atracción de van der Waals entre partículas, se agregarán. Una superficie cargada no es el único parámetro que influye en la estabilidad coloidal. El tamaño de partícula, el potencial zeta y la conductividad, viscosidad y constante dieléctrica del disolvente también determinan la estabilidad de la dispersión. [4] Mientras la dispersión sea estable, la velocidad inicial de deposición estará determinada principalmente por la intensidad del campo eléctrico. La resistencia de la solución puede disipar el voltaje aplicado, por lo que la carga superficial real en cada electrodo puede ser menor que la prevista. Las partículas cargadas se unirán a un sustrato ubicado en el electrodo con carga opuesta. A modo de simplificación, bajo voltajes bajos y tiempos de deposición cortos, la ley de Hamaker [3] describe una relación lineal entre la intensidad del campo, el espesor depositado y el tiempo.
Esta ecuación proporciona la masa depositada electroforéticamente m en gramos, en función de la movilidad electroforética μ (en unidades de cm 2 s −1 ), la carga de sólidos C s (en g cm −3 ), el área de superficie cubierta S (cm 2 ), la intensidad del campo eléctrico E (V cm −1 ) y el tiempo t (s). Esta ecuación es útil para evaluar la eficiencia de los procesos EPD aplicados en relación con los valores teóricos.
La simple aproximación lineal aplicada por la ley de Hamaker se degrada bajo voltajes más altos y tiempos de deposición más largos. Bajo voltaje más alto, las reacciones químicas, como la reducción, impulsadas por la influencia del campo aplicado pueden oscurecer la cinética. Por lo tanto, se deben utilizar solventes con altos potenciales de reducción-oxidación para evitar la electrólisis y la evolución del gas. [4] Y si las partículas depositadas son aislantes, entonces a medida que la capa depositada se vuelve más gruesa, el campo eléctrico efectivo disminuirá. Además, el área que rodea la región electroactiva cerca de los electrodos se agotará de partículas. La difusión de partículas desde la masa a la región electroactiva puede limitar la tasa de crecimiento. La difusión de partículas desde una concentración alta a una baja se puede aproximar mediante las leyes de Fick y su tasa estará determinada por la diferencia en la concentración de partículas, así como por la viscosidad del solvente, la masa de la partícula y la estabilidad coloidal. Finalmente, a medida que aumenta el espesor de la deposición y disminuye la intensidad del campo, el crecimiento se saturará. El cambio de espesor que ocurre al inicio de la saturación se describe mediante la siguiente ecuación. [5]
dónde
w es el peso de las partículas sólidas depositadas en el electrodo, k la constante cinética, t el tiempo de deposición, A el área del electrodo, V el volumen de la suspensión, el peso inicial de las partículas sólidas en la suspensión, ε la constante dieléctrica del líquido, ξ el potencial zeta de la partícula en el solvente, n la viscosidad del solvente, E el voltaje de corriente continua aplicado y E la caída de voltaje a través de la capa depositada. [5]
Antes de la saturación existe una relación lineal entre el espesor de deposición y el tiempo. El inicio de la saturación conduce a una disminución en la velocidad de deposición que se modela como un comportamiento parabólico. El tiempo crítico de transición entre el comportamiento lineal y parabólico se aproxima mediante la siguiente ecuación. [5]
t es el tiempo de transición crítico, es la pendiente del régimen parabólico y es la pendiente de la tasa de crecimiento de la capa de deposición en el régimen lineal.
Para determinar la aplicabilidad de EPD a un sistema es necesario garantizar la estabilidad coloidal y la combinación de voltaje aplicado y tiempo de reacción que producirá el espesor depositado deseado.
En ciertas aplicaciones, como la deposición de materiales cerámicos, no se pueden aplicar voltajes superiores a 3–4 V en EPD acuoso si es necesario evitar la electrólisis del agua. Sin embargo, pueden ser deseables voltajes de aplicación más altos para lograr mayores espesores de recubrimiento o para aumentar la velocidad de deposición. En tales aplicaciones, se utilizan disolventes orgánicos en lugar de agua como medio líquido. Los disolventes orgánicos utilizados son generalmente disolventes polares como alcoholes y cetonas. El etanol , la acetona y la metiletilcetona son ejemplos de disolventes que se han descrito como candidatos adecuados para su uso en la deposición electroforética.