La solución salina tamponada con fosfato ( PBS ) es una solución tampón (pH ~ 7,4) que se utiliza habitualmente en la investigación biológica . Es una solución salina a base de agua que contiene fosfato disódico de hidrógeno , cloruro de sodio y, en algunas formulaciones, cloruro de potasio y fosfato dihidrógeno de potasio . El tampón ayuda a mantener un pH constante. La osmolaridad y las concentraciones de iones de las soluciones son isotónicas , lo que significa que coinciden con las del cuerpo humano.
El PBS tiene muchos usos porque es isotónico y no tóxico para la mayoría de las células. Estos usos incluyen la dilución de sustancias y el enjuague de contenedores de células. El PBS con EDTA también se utiliza para separar células adheridas y aglutinadas. Sin embargo, no se pueden agregar metales divalentes como el zinc , ya que esto provocaría precipitación. Para este tipo de aplicaciones, se recomiendan los tampones de Good . Se ha demostrado que el PBS es una alternativa aceptable al medio de transporte viral en lo que respecta al transporte y almacenamiento de virus de ARN, como el SARS-CoV-2. [1]
Existen muchas formas diferentes de preparar soluciones de PBS, las más comunes son la solución salina tamponada con fosfato de Dulbecco (DPBS) [2] y el protocolo Cold Spring Harbor. [3] Algunas formulaciones de DPBS no contienen potasio ni magnesio, mientras que otras contienen calcio y/o magnesio (dependiendo de si el tampón se utiliza en tejido vivo o fijado: este último no requiere CaCl2 o MgCl2 ) .
Comience con 800 ml de agua destilada para disolver todas las sales. Agregue agua destilada hasta un volumen total de 1 litro. El PBS 1× resultante tendrá una concentración final de 157 mM Na + , 140 mM Cl − , 4,45 mM K + , 10,1 mM HPO 4 2− , 1,76 mM H 2 PO 4 − y un pH de 7,96. Agregue 2,84 mM de HCl para cambiar el tampón a 7,3 mM HPO 4 2− y 4,6 mM H 2 PO 4 − para un pH final de 7,4 y una concentración de Cl − de 142 mM.
El pH del PBS es de aproximadamente 7,4. Al preparar soluciones tampón, es recomendable medir siempre el pH directamente con un medidor de pH. Si es necesario, se puede ajustar el pH con ácido clorhídrico o hidróxido de sodio.
El PBS también se puede preparar utilizando tabletas o bolsas de tampón de PBS fabricadas comercialmente. [4]
Si se utiliza en cultivos celulares, la solución se puede distribuir en alícuotas y esterilizar mediante autoclave o filtración . La esterilización puede no ser necesaria según el uso. El PBS se puede almacenar a temperatura ambiente o en el refrigerador. Sin embargo, las soluciones madre concentradas pueden precipitar al enfriarse y deben mantenerse a temperatura ambiente hasta que el precipitado se haya disuelto por completo antes de su uso.
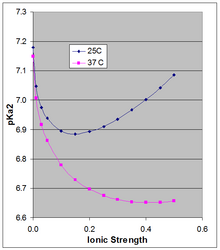
La ecuación de Henderson-Hasselbalch proporciona el pH de una solución en relación con el p K a del par ácido-base. Sin embargo, el p K a depende de la fuerza iónica y la temperatura, y a medida que cambia, también lo hará el pH de una solución en función de ese par ácido-base. Debido a que el [HPO 4 ] 2− con doble carga se estabiliza más por una fuerza iónica alta que el [H 2 PO 4 ] − con una sola carga , su p K a depende en cierta medida de la fuerza iónica. El p K a de ~7,2, que se cita con frecuencia, es el valor extrapolado a una fuerza iónica cero y no es aplicable a una fuerza iónica fisiológica.
Phillips et al. [5] midieron el p K a a 10, 25 y 37 °C a distintas intensidades iónicas. Para las dos últimas temperaturas, informaron el p K a en ecuaciones de Debye-Hückel (graficadas en la figura adjunta para μ hasta 0,5 M):
a 25 °C: pKa 2 = 7,18 − 1,52 sqrt(μ) + 1,96 μ
a 37 °C: pKa 2 = 7,15 − 1,56 sqrt(μ) + 1,22 μ
El p K a 0 depende débilmente de la temperatura. Phillips et al. informaron un ∆H 0 a 25 °C de 760 cal/mol (3180 J/mol) y una dependencia lineal de p K a 0 en 1/ T ( ecuación de Van 't Hoff ). El ∆H 0 positivo resulta en un aumento en K a , y por lo tanto una disminución en p K a 0 con el aumento de la temperatura, siendo el cambio en pKa 0 166 × el cambio en (1/ T ), que alrededor de 25 °C resulta en un cambio en p K a 0 de −0,00187 por grado. Esto se aplica estrictamente al p K a 0 termodinámico extrapolado a dilución infinita y, como muestra la figura, el efecto de la temperatura puede ser mucho mayor a mayor fuerza iónica.