Peroxibenzoato de terc -butilo ( TBPB ) es un compuesto orgánico con la fórmula C6H5CO3CMe3 ( Me=CH3 ) . Es el peréster más ampliamente producido ; es un éster de ácido peroxibenzoico ( C6H5CO3H ) . Se utiliza a menudo como iniciador de radicales en reacciones de polimerización, como la producción de LDPE a partir de etileno , y para reticulación , como para resinas de poliéster insaturado .[ 1]
El TBPB, que es de color amarillo pálido, se encuentra exclusivamente como solución en disolventes como el etanol o el ftalato. [2]
Como compuesto peroxo, el TBPB contiene aproximadamente 8,16 % en peso de oxígeno activo y tiene una temperatura de descomposición autoacelerada (SADT) de aproximadamente 60 °C. La SADT es la temperatura más baja a la que puede ocurrir la descomposición autoacelerada en el embalaje de transporte en una semana, y que no debe superarse durante el almacenamiento o el transporte. [3] Por lo tanto, el TBPB debe almacenarse entre un mínimo de 10 °C (por debajo de la solidificación ) y un máximo de 50 °C. La dilución con un disolvente de alto punto de ebullición aumenta la SADT. La vida media del TBPB, en la que se descompone el 50 % del éster peroxi, es de 10 horas a 104 °C, una hora a 124 °C y un minuto a 165 °C. Las aminas, los iones metálicos , los ácidos y bases fuertes , así como los agentes reductores y oxidantes fuertes aceleran la descomposición del TBPB incluso en concentraciones bajas. [3] Sin embargo, el TBPB es uno de los perésteres o peróxidos orgánicos más seguros en su manipulación. [4] Los principales productos de descomposición del peroxibenzoato de terc -butilo son dióxido de carbono , acetona , metano , terc -butanol , ácido benzoico y benceno . [5]
Un procedimiento estándar para la preparación de perésteres es la acilación de hidroperóxido de terc -butilo con cloruro de benzoilo . [6] En la reacción se utiliza un gran exceso de hidroperóxido de terc -butilo y el cloruro de hidrógeno formado se elimina al vacío con lo que se obtiene un rendimiento prácticamente cuantitativo .

Principalmente, el TBPB se utiliza como iniciador de radicales , ya sea en la polimerización de, por ejemplo, etileno (a LDPE), cloruro de vinilo, estireno o ésteres acrílicos o como las llamadas resinas de poliéster insaturado (resinas UP). [2] La cantidad utilizada para el curado de resinas UP es de aproximadamente 1-2%. [2]
Una desventaja, especialmente en la producción de polímeros para aplicaciones en el sector alimentario o cosmético, es la posible formación de benceno como producto de descomposición que puede difundirse fuera del polímero (por ejemplo, una película de embalaje de LDPE).
El grupo protector cloruro de 2-trimetilsililetanosulfonilo (SES-Cl) para los grupos amino primarios y secundarios es accesible mediante la reacción de viniltrimetilsilano con hidrogenosulfito de sodio y TBPB para obtener la sal de sodio del ácido trimetilsililetanosulfónico y la reacción posterior con cloruro de tionilo para obtener el cloruro de sulfonilo correspondiente. [4]

El TBPB se puede utilizar para introducir un grupo benzoiloxi en la posición alilo de hidrocarburos insaturados. [7]

A partir del ciclohexeno, se forma 3-benzoiloxiciclohexeno con TBPB en presencia de cantidades catalíticas de bromuro de cobre (I) con un rendimiento del 71 al 80%.
Esta oxidación alílica de alquenos, también conocida como oxidación de Kharasch-Sosnovsky , genera benzoatos alílicos racémicos en presencia de cantidades catalíticas de bromuro de cobre (I) . [8]

Una modificación de la reacción utiliza trifluorometanosulfonato de cobre (II) como catalizador y DBN o DBU como bases para lograr rendimientos de hasta el 80% en la reacción de olefinas acíclicas con TBPB a benzoatos alílicos. [9]
Las oxazolinas y tiazolinas sustituidas se pueden oxidar a los oxazoles y tiazoles correspondientes en una oxidación de Kharash-Sosnovsky modificada con TBPB y una mezcla de sales de Cu(I) y Cu(II) en rendimientos adecuados. [10]

El grupo carboalcoxi en la posición C-4 es esencial para una reacción exitosa.
El benceno y los furanos se pueden alquenilar con olefinas en un acoplamiento oxidativo bajo catálisis de sal de paladio, con TBPB como aceptor de hidrógeno. [11]
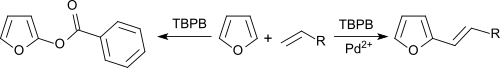
En ausencia de sales de Pd2 + , los aromáticos están benzoxilados.
{{citation}}: CS1 maint: varios nombres: lista de autores ( enlace ){{citation}}: CS1 maint: varios nombres: lista de autores ( enlace )