La química de los organofosforados es el estudio científico de la síntesis y las propiedades de los compuestos organofosforados , que son compuestos orgánicos que contienen fósforo . [1] Se utilizan principalmente en el control de plagas como una alternativa a los hidrocarburos clorados que persisten en el medio ambiente. Algunos compuestos organofosforados son insecticidas muy eficaces , aunque algunos son extremadamente tóxicos para los humanos, incluidos los agentes nerviosos sarín y VX . [2]
El fósforo, al igual que el nitrógeno , se encuentra en el grupo 15 de la tabla periódica, por lo que los compuestos de fósforo y los compuestos de nitrógeno tienen muchas propiedades similares. [3] [4] [5] La definición de compuestos organofosforados es variable, lo que puede generar confusión. En química industrial y ambiental, un compuesto organofosforado solo necesita contener un sustituyente orgánico , pero no necesita tener un enlace fósforo-carbono (PC) directo. [ cita requerida ] Por lo tanto, una gran proporción de pesticidas (por ejemplo, malatión ), a menudo se incluyen en esta clase de compuestos.
El fósforo puede adoptar una variedad de estados de oxidación y es general clasificar los compuestos organofosforados en función de si son derivados del fósforo (V) frente al fósforo (III), que son las clases predominantes de compuestos. En una nomenclatura descriptiva pero utilizada solo de manera intermitente, los compuestos de fósforo se identifican por su número de coordinación σ y su valencia λ . En este sistema, una fosfina es un compuesto σ 3 λ 3 .
Los ésteres de fosfato tienen la estructura general P(=O)(OR) 3 característica P(V). Estas especies son de importancia tecnológica como agentes retardantes de llama y plastificantes . Al carecer de un enlace P−C, estos compuestos en el sentido técnico no son compuestos organofosforados sino ésteres de ácido fosfórico. Muchos derivados se encuentran en la naturaleza, como la fosfatidilcolina . Los ésteres de fosfato se sintetizan por alcoholisis de oxicloruro de fósforo. Se conocen una variedad de derivados mixtos de amido-alcoxo, un ejemplo médicamente significativo es el fármaco contra el cáncer ciclofosfamida . También los derivados que contienen el grupo tiofosforilo (P=S) incluyen el pesticida malatión . Los organofosfatos preparados en la mayor escala son los ditiofosfatos de zinc , como aditivos para aceite de motor. Varios millones de kilogramos de este complejo de coordinación se producen anualmente por la reacción de pentasulfuro de fósforo con alcoholes. [6]

En el medio ambiente, estos compuestos se descomponen mediante hidrólisis para finalmente producir fosfato y el alcohol orgánico o amina de los que se derivan.
Los fosfonatos son ésteres del ácido fosfónico y tienen la fórmula general RP(=O)(OR') 2 . Los fosfonatos tienen muchas aplicaciones técnicas, siendo un miembro bien conocido el glifosato , más conocido como Roundup. Con la fórmula (HO) 2 P(O)CH 2 NHCH 2 CO 2 H, este derivado de la glicina es uno de los herbicidas más utilizados. Los bifosfonatos son una clase de fármacos para tratar la osteoporosis . El gas nervioso sarín , que contiene enlaces C–P y F–P, es un fosfonato.
Los fosfinatos presentan dos enlaces P–C y su fórmula general es R 2 P(=O)(OR'). Un miembro comercialmente importante es el herbicida glufosinato . Al igual que el glifosato mencionado anteriormente, tiene la estructura CH 3 P(O)(OH)CH 2 CH 2 CH(NH 2 )CO 2 H.
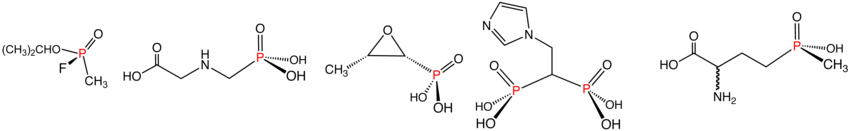
La reacción de Michaelis-Arbuzov es el principal método para la síntesis de estos compuestos. Por ejemplo, el dimetilmetilfosfonato (véase la figura anterior) surge de la transposición del trimetilfosfito , que es catalizada por el yoduro de metilo . En la reacción de Horner-Wadsworth-Emmons y la homologación de Seyferth-Gilbert , los fosfonatos se utilizan en reacciones con compuestos carbonílicos . La reacción de Kabachnik-Fields es un método para la preparación de aminofosfonatos. Estos compuestos contienen un enlace muy inerte entre el fósforo y el carbono. En consecuencia, se hidrolizan para dar derivados del ácido fosfónico y fosfínico, pero no fosfato.
Los óxidos de fosfina (designación σ 4 λ 5 ) tienen la estructura general R 3 P=O con estado de oxidación formal V. Los óxidos de fosfina forman enlaces de hidrógeno y, por lo tanto, algunos son solubles en agua. El enlace P=O es muy polar con un momento dipolar de 4,51 D para el óxido de trifenilfosfina .
Los compuestos relacionados con los óxidos de fosfina incluyen imidas de fosfina (R 3 PNR') y calcogenuros relacionados (R 3 PE, donde E = S , Se , Te ). Estos compuestos son algunos de los compuestos organofosforados más estables térmicamente.
Los compuestos con la fórmula [PR 4 + ]X − comprenden las sales de fosfonio . Estas especies son compuestos tetraédricos de fósforo (V). Desde la perspectiva comercial, el miembro más importante es el cloruro de tetrakis(hidroximetil)fosfonio , [P(CH 2 OH) 4 ]Cl, que se utiliza como retardante de fuego en textiles . Anualmente se producen aproximadamente 2 millones de kg del cloruro y del sulfato relacionado. [6] Se generan por la reacción de la fosfina con formaldehído en presencia del ácido mineral:
Se pueden preparar diversas sales de fosfonio mediante alquilación y arilación de organofosfinas:
La metilación de la trifenilfosfina es el primer paso en la preparación del reactivo de Wittig.

El fosforano original (σ 5 λ 5 ) es PH 5 , que se desconoce. [ cita requerida ] Los compuestos relacionados que contienen tanto haluro como sustituyentes orgánicos en el fósforo son bastante comunes. Los que tienen cinco sustituyentes orgánicos son raros, aunque se conoce el P(C 6 H 5 ) 5 , que se deriva del P(C 6 H 5 ) 4 + por reacción con fenillitio .
Los iluros de fósforo son fosforanos insaturados, conocidos como reactivos de Wittig , p. ej., CH2P ( C6H5 ) 3 . Estos compuestos presentan fósforo(V) tetraédrico y se consideran parientes de los óxidos de fosfina. También se derivan de sales de fosfonio, pero por desprotonación, no por alquilación.
Los fosfitos, a veces llamados ésteres de fosfito , tienen la estructura general P(OR) 3 con estado de oxidación +3. Estas especies surgen de la alcoholisis del tricloruro de fósforo:
La reacción es general, por lo que se conocen un gran número de especies de este tipo. Los fosfitos se emplean en la reacción de Perkow y en la reacción de Michaelis-Arbuzov . También sirven como ligandos en la química organometálica.
Los intermedios entre los fosfitos y las fosfinas son los fosfonitos (P(OR) 2 R') y el fosfinito (P(OR)R' 2 ). Estas especies surgen a través de reacciones de alcoholisis de los cloruros fosfonosos y fosfinosos correspondientes ((PCl 2 R') y (PClR' 2 ) , respectivamente). Estos últimos se producen por reacción de un tricloruro de fósforo con un complejo de metal-alquilo pobre , por ejemplo, organomercurio , organoplomo o un compuesto mixto de litio - organoaluminio . [7]
El compuesto original de las fosfinas es PH 3 , llamado fosfina en los EE. UU. y la Commonwealth británica, pero fosfano en otros lugares. [8] La sustitución de uno o más centros de hidrógeno por sustituyentes orgánicos (alquilo, arilo) da PH 3−x R x , una organofosfina, generalmente denominada fosfinas.
Desde el punto de vista comercial, la fosfina más importante es la trifenilfosfina , de la que se producen varios millones de kilogramos al año. Se prepara a partir de la reacción de clorobenceno , PCl3 y sodio. [6] Las fosfinas de naturaleza más especializada se preparan normalmente por otras vías. [9] Los haluros de fósforo sufren un desplazamiento nucleofílico mediante reactivos organometálicos como los reactivos de Grignard . Las organofosfinas son nucleófilos y ligandos . Dos de sus principales aplicaciones son como reactivos en la reacción de Wittig y como ligandos de fosfina de soporte en catálisis homogénea .
Su nucleofilia se evidencia por sus reacciones con haluros de alquilo para dar sales de fosfonio . Las fosfinas son catalizadores nucleofílicos en la síntesis orgánica , por ejemplo, la reacción de Rauhut-Currier y la reacción de Baylis-Hillman . Las fosfinas son agentes reductores , como se ilustra en la reducción de Staudinger para la conversión de azidas orgánicas en aminas y en la reacción de Mitsunobu para convertir alcoholes en ésteres. En estos procesos, la fosfina se oxida a fósforo (V). También se ha descubierto que las fosfinas reducen grupos carbonilo activados, por ejemplo, la reducción de un éster α-ceto a un éster α-hidroxi. [10]
Los compuestos con enlaces múltiples carbono-fósforo(III) se denominan fosfaalquenos (R 2 C=PR) y fosfaalquinos (RC≡P). Son similares en estructura, pero no en reactividad, a las iminas (R 2 C=NR) y a los nitrilos (RC≡N), respectivamente. En el compuesto fosforina , un átomo de carbono del benceno se reemplaza por fósforo. Las especies de este tipo son relativamente raras, pero por esa razón son de interés para los investigadores. Un método general para la síntesis de fosfaalquenos es mediante la eliminación 1,2 de precursores adecuados, iniciada térmicamente o por una base como DBU , DABCO o trietilamina :
La termólisis de Me 2 PH genera CH 2 =PMe, una especie inestable en la fase condensada.
Los compuestos en los que el fósforo existe en un estado de oxidación formal inferior a III son poco comunes, pero se conocen ejemplos para cada clase. Las especies de organofosforados(0) se ilustran de manera discutible mediante los aductos de carbeno, [P(NHC)] 2 , donde NHC es un carbeno N-heterocíclico . [11] Con las fórmulas (RP) n y (R 2 P) 2 , respectivamente, los compuestos de fósforo(I) y (II) se generan por reducción de los cloruros de organofosforados(III) relacionados:
Los difosfenos , con la fórmula R 2 P 2 , contienen formalmente enlaces dobles fósforo-fósforo. Estas especies de fósforo (I) son raras pero son estables siempre que los sustituyentes orgánicos sean lo suficientemente grandes para evitar la concatenación . Los sustituyentes voluminosos también estabilizan los radicales de fósforo .
Se conocen muchos compuestos de valencia mixta , por ejemplo el compuesto P 7 (CH 3 ) 3 .