En química , una interacción no covalente se diferencia de un enlace covalente en que no implica compartir electrones , [1] sino que implica variaciones más dispersas de interacciones electromagnéticas entre moléculas o dentro de una molécula. La energía química liberada en la formación de interacciones no covalentes suele ser del orden de 1 a 5 kcal/ mol (1000 a 5000 calorías por 6,02 × 1023 moléculas). [2] Las interacciones no covalentes se pueden clasificar en diferentes categorías, como electrostáticas , efectos π , fuerzas de van der Waals y efectos hidrofóbicos . [3] [2]
Las interacciones no covalentes [4] son fundamentales para mantener la estructura tridimensional de moléculas grandes, como las proteínas y los ácidos nucleicos . También están implicadas en muchos procesos biológicos en los que las moléculas grandes se unen específicamente pero de forma transitoria entre sí (consulte la sección de propiedades de la página del ADN ). Estas interacciones también influyen en gran medida en el diseño de fármacos , la cristalinidad y el diseño de materiales, en particular para el autoensamblaje y, en general, en la síntesis de muchas moléculas orgánicas . [3] [5] [6] [7] [8]
Las interacciones no covalentes pueden ocurrir entre diferentes partes de la misma molécula (por ejemplo, durante el plegamiento de proteínas ) o entre diferentes moléculas y, por lo tanto, también se analizan como fuerzas intermoleculares .
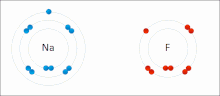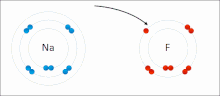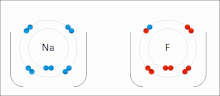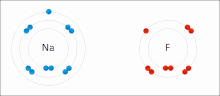
Las interacciones iónicas implican la atracción de iones o moléculas con cargas permanentes completas de signos opuestos. Por ejemplo, el fluoruro de sodio implica la atracción de la carga positiva del sodio (Na + ) con la carga negativa del fluoruro (F − ). [9] Sin embargo, esta interacción particular se rompe fácilmente al agregar agua u otros solventes altamente polares . En el agua, el apareamiento iónico está impulsado principalmente por la entropía; un solo puente salino generalmente equivale a un valor de atracción de aproximadamente ΔG = 5 kJ/mol a una fuerza iónica intermedia I, a I cerca de cero el valor aumenta a aproximadamente 8 kJ/mol. Los valores de ΔG suelen ser aditivos y en gran medida independientes de la naturaleza de los iones participantes, excepto para los iones de metales de transición , etc. [10]
Estas interacciones también se pueden observar en moléculas con una carga localizada en un átomo en particular . Por ejemplo, la carga negativa total asociada con el etóxido , la base conjugada del etanol , suele ir acompañada de la carga positiva de una sal de metal alcalino , como el catión sodio (Na + ).

Un enlace de hidrógeno (enlace H) es un tipo específico de interacción que implica la atracción dipolo-dipolo entre un átomo de hidrógeno parcialmente positivo y un átomo de oxígeno, nitrógeno, azufre o flúor altamente electronegativo y parcialmente negativo (no unido covalentemente a dicho átomo de hidrógeno). No es un enlace covalente, sino que se clasifica como una interacción no covalente fuerte. Es responsable de por qué el agua es un líquido a temperatura ambiente y no un gas (dado el bajo peso molecular del agua ). Lo más común es que la fuerza de los enlaces de hidrógeno se encuentre entre 0 y 4 kcal/mol, pero a veces puede ser tan fuerte como 40 kcal/mol [3] En disolventes como el cloroformo o el tetracloruro de carbono se observa, por ejemplo, para la interacción entre amidas, valores aditivos de aproximadamente 5 kJ/mol. Según Linus Pauling, la fuerza de un enlace de hidrógeno está determinada esencialmente por las cargas electrostáticas. Las mediciones de miles de complejos en cloroformo o tetracloruro de carbono han llevado a incrementos aditivos de energía libre para todo tipo de combinaciones de donador-aceptor. [11] [12]

El enlace halógeno es un tipo de interacción no covalente que no implica la formación ni la ruptura de enlaces reales, sino que es similar a la interacción dipolo-dipolo conocida como enlace de hidrógeno . En el enlace halógeno, un átomo de halógeno actúa como un electrófilo , o especie que busca electrones, y forma una interacción electrostática débil con un nucleófilo , o especie rica en electrones. El agente nucleófilo en estas interacciones tiende a ser altamente electronegativo (como oxígeno , nitrógeno o azufre ), o puede ser aniónico , con una carga formal negativa . En comparación con el enlace de hidrógeno, el átomo de halógeno toma el lugar del hidrógeno parcialmente cargado positivamente como electrófilo. [ cita requerida ]
El enlace halógeno no debe confundirse con las interacciones halógeno-aromático, ya que ambas están relacionadas pero difieren por definición. Las interacciones halógeno-aromático involucran una nube π aromática rica en electrones como nucleófilo; el enlace halógeno está restringido a los nucleófilos monoatómicos. [5]
Las fuerzas de Van der Waals son un subconjunto de interacciones electrostáticas que involucran dipolos permanentes o inducidos (o multipolos). Entre ellas se incluyen las siguientes:
Los enlaces de hidrógeno y de halógeno normalmente no se clasifican como fuerzas de Van der Waals.

Las interacciones dipolo-dipolo son interacciones electrostáticas entre dipolos permanentes en las moléculas. Estas interacciones tienden a alinear las moléculas para aumentar la atracción (reduciendo la energía potencial ). Normalmente, los dipolos están asociados con átomos electronegativos , incluidos el oxígeno , el nitrógeno , el azufre y el flúor .
Por ejemplo, la acetona , el ingrediente activo de algunos quitaesmaltes, tiene un dipolo neto asociado con el carbonilo (ver figura 2). Como el oxígeno es más electronegativo que el carbono que está unido a él mediante un enlace covalente, los electrones asociados con ese enlace estarán más cerca del oxígeno que del carbono, creando una carga negativa parcial (δ − ) en el oxígeno y una carga positiva parcial (δ + ) en el carbono. No son cargas completas porque los electrones todavía se comparten a través de un enlace covalente entre el oxígeno y el carbono. Si los electrones ya no se compartieran, entonces el enlace oxígeno-carbono sería una interacción electrostática.
A menudo, las moléculas contienen grupos dipolares, pero no tienen un momento dipolar global . Esto ocurre si existe simetría dentro de la molécula que hace que los dipolos se cancelen entre sí. Esto ocurre en moléculas como el tetraclorometano . Tenga en cuenta que la interacción dipolo-dipolo entre dos átomos individuales suele ser cero, ya que los átomos rara vez tienen un dipolo permanente. Consulte dipolos atómicos .
Una interacción dipolo-dipolo inducido ( fuerza de Debye ) se debe al acercamiento de una molécula con un dipolo permanente a otra molécula no polar sin dipolo permanente. Este acercamiento hace que los electrones de la molécula no polar se polaricen hacia o desde el dipolo (o "induzcan" un dipolo) de la molécula que se aproxima. [13] En concreto, el dipolo puede provocar atracción o repulsión electrostática de los electrones de la molécula no polar, dependiendo de la orientación del dipolo entrante. [13] Los átomos con radios atómicos mayores se consideran más "polarizables" y, por tanto, experimentan mayores atracciones como resultado de la fuerza de Debye. [ cita requerida ]
Las fuerzas de dispersión de London [14] [15] [16] [17] son el tipo más débil de interacción no covalente. Sin embargo, en las moléculas orgánicas, la multitud de contactos puede dar lugar a contribuciones mayores, en particular en presencia de heteroátomos. También se conocen como "interacciones dipolo inducido-dipolo inducido" y están presentes entre todas las moléculas, incluso aquellas que inherentemente no tienen dipolos permanentes. Las interacciones dispersivas aumentan con la polarizabilidad de los grupos interactuantes, pero se debilitan con disolventes de mayor polarizabilidad. [18] Son causadas por la repulsión temporal de electrones lejos de los electrones de una molécula vecina, lo que da lugar a un dipolo parcialmente positivo en una molécula y un dipolo parcialmente negativo en otra molécula. [6] El hexano es un buen ejemplo de una molécula sin polaridad o átomos altamente electronegativos, pero es un líquido a temperatura ambiente debido principalmente a las fuerzas de dispersión de London. En este ejemplo, cuando una molécula de hexano se aproxima a otra, un dipolo parcialmente negativo, débil y temporal en el hexano entrante puede polarizar la nube de electrones de otro, lo que provoca un dipolo parcialmente positivo en esa molécula de hexano. En ausencia de disolventes, los hidrocarburos como el hexano forman cristales debido a fuerzas dispersivas; el calor de sublimación de los cristales es una medida de la interacción dispersiva. Si bien estas interacciones son de corta duración y muy débiles, pueden ser responsables de que ciertas moléculas no polares sean líquidas a temperatura ambiente.
Los efectos π se pueden dividir en numerosas categorías, entre las que se incluyen el apilamiento π , las interacciones catión-π y anión-π y las interacciones polares-π. En general, los efectos π están asociados con las interacciones de las moléculas con los sistemas π de arenos . [3]

Las interacciones π–π están asociadas con la interacción entre los orbitales π de un sistema molecular. [3] La alta polarizabilidad de los anillos aromáticos conduce a interacciones dispersivas como una contribución importante a los llamados efectos de apilamiento . Estos juegan un papel importante para las interacciones de nucleobases, por ejemplo, en el ADN. [19] Para un ejemplo simple, un anillo de benceno, con su nube π completamente conjugada , interactuará de dos maneras principales (y una manera menor) con un anillo de benceno vecino a través de una interacción π–π (ver figura 3). Las dos formas principales en que se apila el benceno son de borde a cara, con una entalpía de ~2 kcal/mol, y desplazada (o apilada por deslizamiento), con una entalpía de ~2,3 kcal/mol. [3] La configuración sándwich no es una interacción tan estable como las dos mencionadas anteriormente debido a la alta repulsión electrostática de los electrones en los orbitales π. [3]

Las interacciones catión-pi pueden ser tan fuertes o más fuertes que los enlaces de hidrógeno en algunos contextos. [3] [20]
Las interacciones anión-π son muy similares a las interacciones catión-π, pero a la inversa. En este caso, un anión se asienta sobre un sistema π pobre en electrones, generalmente establecido por la presencia de sustituyentes que atraen electrones en la molécula conjugada [21].

Las interacciones polares-π involucran moléculas con dipolos permanentes (como el agua) que interactúan con el momento cuadrupolar de un sistema π (como el del benceno (ver figura 5). Si bien no son tan fuertes como una interacción catión-π, estas interacciones pueden ser bastante fuertes (~1-2 kcal/mol), y están comúnmente involucradas en el plegamiento de proteínas y la cristalinidad de sólidos que contienen tanto enlaces de hidrógeno como sistemas π. [3] De hecho, cualquier molécula con un donante de enlaces de hidrógeno (hidrógeno unido a un átomo altamente electronegativo) tendrá interacciones electrostáticas favorables con el sistema π rico en electrones de una molécula conjugada. [ cita requerida ]
El efecto hidrofóbico es el deseo de las moléculas no polares de agregarse en soluciones acuosas para separarse del agua. [22] Este fenómeno conduce a un área de superficie expuesta mínima de moléculas no polares a las moléculas de agua polares (típicamente gotitas esféricas), y se usa comúnmente en bioquímica para estudiar el plegamiento de proteínas y otros fenómenos biológicos. [22] El efecto también se observa comúnmente al mezclar varios aceites (incluido el aceite de cocina) y agua. Con el tiempo, el aceite que se asienta sobre el agua comenzará a agregarse en grandes esferas aplanadas a partir de gotitas más pequeñas, lo que eventualmente conducirá a una película de todo el aceite que se asienta sobre un charco de agua. Sin embargo, el efecto hidrofóbico no se considera una interacción no covalente, ya que es una función de la entropía y no una interacción específica entre dos moléculas, generalmente caracterizada por la compensación de entropía-entalpía. [23] [24] [25] Un efecto hidrofóbico esencialmente entálpico se materializa si un número limitado de moléculas de agua están restringidas dentro de una cavidad; El desplazamiento de dichas moléculas de agua por un ligando libera las moléculas de agua que luego, en el agua a granel, disfrutan de un máximo de enlaces de hidrógeno cercano a cuatro. [26] [27]
La mayoría de los fármacos son moléculas pequeñas que provocan una respuesta fisiológica al "unirse" a enzimas o receptores , lo que provoca un aumento o disminución de la capacidad de la enzima para funcionar. La unión de una molécula pequeña a una proteína está regida por una combinación de consideraciones estéricas o espaciales, además de varias interacciones no covalentes, aunque algunos fármacos modifican covalentemente un sitio activo (ver inhibidores irreversibles ). Usando el "modelo de cerradura y llave" de unión enzimática, un fármaco (llave) debe tener aproximadamente las dimensiones adecuadas para encajar en el sitio de unión de la enzima (cerradura). [28] Usando el andamiaje molecular de tamaño apropiado, los fármacos también deben interactuar con la enzima de forma no covalente para maximizar la afinidad de unión constante de unión y reducir la capacidad del fármaco para disociarse del sitio de unión . Esto se logra mediante la formación de varias interacciones no covalentes entre la molécula pequeña y los aminoácidos en el sitio de unión, que incluyen: enlaces de hidrógeno , interacciones electrostáticas , apilamiento pi , interacciones de van der Waals e interacciones dipolo-dipolo .
Se han desarrollado fármacos metálicos no covalentes. Por ejemplo, se han preparado compuestos dinucleares de triple hélice en los que tres cadenas de ligando se envuelven alrededor de dos metales, lo que da como resultado un tetracatión aproximadamente cilíndrico. Estos compuestos se unen a las estructuras de ácidos nucleicos menos comunes, como el ADN dúplex, las estructuras de horquilla en forma de Y y las uniones de 4 vías. [29]
El plegamiento de proteínas desde una secuencia primaria (lineal) de aminoácidos a una estructura tridimensional está dirigido por todo tipo de interacciones no covalentes , incluidas las fuerzas hidrofóbicas y la formación de enlaces de hidrógeno intramoleculares . Las estructuras tridimensionales de las proteínas , incluidas las estructuras secundarias y terciarias , se estabilizan mediante la formación de enlaces de hidrógeno. A través de una serie de pequeños cambios conformacionales, las orientaciones espaciales se modifican para llegar a la orientación energéticamente más minimizada alcanzable. El plegamiento de proteínas a menudo se facilita mediante enzimas conocidas como chaperonas moleculares . [30] La estérica , la tensión de enlace y la tensión angular también juegan un papel importante en el plegamiento de una proteína desde su secuencia primaria a su estructura terciaria.
Las estructuras proteicas terciarias individuales también pueden ensamblarse para formar complejos proteicos compuestos de múltiples subunidades plegadas independientemente. En conjunto, esto se denomina estructura cuaternaria de una proteína . La estructura cuaternaria se genera por la formación de interacciones no covalentes relativamente fuertes, como enlaces de hidrógeno, entre diferentes subunidades para generar una enzima polimérica funcional. [31] Algunas proteínas también utilizan interacciones no covalentes para unir cofactores en el sitio activo durante la catálisis, sin embargo, un cofactor también puede unirse covalentemente a una enzima. Los cofactores pueden ser moléculas orgánicas o inorgánicas que ayudan en el mecanismo catalítico de la enzima activa. La fuerza con la que un cofactor se une a una enzima puede variar mucho; los cofactores unidos de forma no covalente suelen estar anclados por enlaces de hidrógeno o interacciones electrostáticas .
Las interacciones no covalentes tienen un efecto significativo en el punto de ebullición de un líquido. El punto de ebullición se define como la temperatura a la que la presión de vapor de un líquido es igual a la presión que rodea al líquido. Más simplemente, es la temperatura a la que un líquido se convierte en gas . Como se podría esperar, cuanto más fuertes sean las interacciones no covalentes presentes en una sustancia, mayor será su punto de ebullición. Por ejemplo, considere tres compuestos de composición química similar: n-butóxido de sodio (C 4 H 9 ONa), éter dietílico (C 4 H 10 O) y n-butanol (C 4 H 9 OH).

Las interacciones no covalentes predominantes asociadas con cada especie en solución se enumeran en la figura anterior. Como se discutió previamente, las interacciones iónicas requieren considerablemente más energía para romperse que los enlaces de hidrógeno , que a su vez requieren más energía que las interacciones dipolo-dipolo . Las tendencias observadas en sus puntos de ebullición (figura 8) muestran exactamente la correlación esperada, donde el n-butóxido de sodio requiere significativamente más energía térmica (temperatura más alta) para hervir que el n-butanol, que hierve a una temperatura mucho más alta que el éter dietílico. La energía térmica requerida para que un compuesto cambie de líquido a gas está asociada con la energía requerida para romper las fuerzas intermoleculares que cada molécula experimenta en su estado líquido.