El pliegue neural es una estructura que surge durante la neurulación en el desarrollo embrionario tanto de aves como de mamíferos , entre otros organismos. [1] [2] Esta estructura está asociada con la neurulación primaria , lo que significa que se forma mediante la unión de capas de tejido, en lugar de una agrupación y posterior vaciamiento de células individuales (conocida como neurulación secundaria ). En los humanos, los pliegues neurales son responsables de la formación del extremo anterior del tubo neural . Los pliegues neurales se derivan de la placa neural , una estructura preliminar que consiste en células ectodérmicas alargadas . Los pliegues dan lugar a las células de la cresta neural , además de provocar la formación del tubo neural . [1] [3]
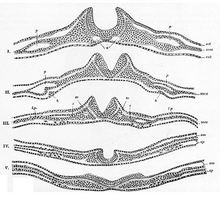
En el embrión, la formación de los pliegues neurales se origina en la zona donde convergen la placa neural y el ectodermo circundante . Esta región del embrión se forma después de la gastrulación y está formada por tejido epitelial. Aquí, las células epiteliales se alargan mediante la polimerización de los microtúbulos , aumentando su altura. La miniatura que aparece a continuación muestra este proceso, así como la posterior formación de las células de la cresta neural y del tubo neural, que surgen de la unión de los pliegues neurales. [4]

La formación del pliegue neural se inicia con la liberación de calcio desde el interior de las células. El calcio liberado interactúa con proteínas que pueden modificar los filamentos de actina en el tejido epitelial externo, o ectodermo, para inducir los movimientos celulares dinámicos necesarios para crear el pliegue. [6] Estas células se mantienen unidas por cadherinas (específicamente E y N-cadherina), tipos de proteínas de unión intercelular. Cuando las células en los picos de los pliegues neurales se acercan entre sí, es la afinidad por moléculas de cadherina similares (N-cadherinas) lo que permite que estas células se unan entre sí. Por lo tanto, cuando las células precursoras del tubo neural comienzan a expresar N-cadherina en el lugar de E-cadherina, esto hace que el tubo neural se forme y se separe del ectodermo y se asiente dentro del embrión. [1] Cuando las células no se asocian de una manera que no es parte del curso normal del desarrollo, pueden ocurrir enfermedades graves.
El proceso de plegamiento comienza cuando las células de la región central de la placa neural, las células del punto de articulación medial, se unen a la notocorda que se encuentra debajo de ellas. Esto crea un punto de anclaje central para que se produzca el proceso de plegamiento y, posteriormente, crea el surco neural . A medida que los pliegues neurales continúan extendiéndose, se forman los puntos de articulación dorsolaterales, lo que permite que los pliegues se curven hasta formar una estructura similar a un tubo. Cuando los picos de los pliegues (conocidos como regiones de la cresta neural) se tocan, se fusionan y se involucionan, creando el tubo neural debajo de la capa epidérmica recién formada. [7]
El mecanismo molecular detrás de este proceso radica en la expresión y represión de las proteínas morfogenéticas óseas (BMP). Las BMP son una amplia familia de proteínas que realizan muchas funciones a lo largo del embrión en crecimiento, incluida la estimulación del crecimiento del cartílago y el hueso. Para permitir el crecimiento de los tejidos neurales precursores, a diferencia de los tejidos precursores del hueso o el cartílago, la expresión de BMP disminuye en la placa neural, específicamente a lo largo de la línea medial, donde pronto se formará el surco neural. Las proteínas producidas a partir de los genes Noggin y Chordin inhiben estas BMP y, posteriormente, permiten que se expresen los genes de compromiso neural, como SOX . Estos genes codifican factores de transcripción , que alteran la expresión genómica de estas células, impulsándolas a lo largo del camino del compromiso celular neural. [8] Este proceso de inhibición de BMP permite el anclaje de las células del punto de bisagra medial, proporcionando a los pliegues neurales la base necesaria para que se produzca el plegamiento y el cierre. Noggin y Chordin tienen otras funciones en el proceso de neurulación, incluida la estimulación de las células de la cresta neural para que emigren del tubo neural recién formado. [9] [10] El gen Sonic hedgehog también desempeña un papel en la atenuación de la expresión de BMP, la formación del punto de articulación medial al tiempo que inhibe la formación de los puntos de articulación dorsolaterales y en asegurar el cierre adecuado de los pliegues neurales. [11] Se cree que la placa precordal, la notocorda y el ectodermo no neural son tejidos inductores importantes que liberan estas señales químicas para desencadenar el plegamiento de la placa neural. [8]
La adhesión final de los pliegues neurales convergentes se debe a varios tipos diferentes de proteínas de unión intercelular. Las cadherinas y sus moléculas receptoras CAM, por ejemplo, están presentes en dos tipos en el tejido precursor neural: la E-cadherina mantiene adheridas entre sí las células de la placa neural y el ectodermo circundante, mientras que la N-cadherina hace lo mismo con las células del pliegue neural. Solo las células que expresan el mismo tipo de cadherina pueden unirse entre sí; dado que los picos de los pliegues neurales expresan N-cadherina, pueden fusionarse en una lámina continua de células. Asimismo, es esta afinidad disminuida entre las células que expresan diferentes tipos de cadherina lo que permite que las células precursoras del tubo neural se separen del ectodermo, formando el tubo neural en el interior del embrión y la epidermis verdadera en el exterior. [1] Otro conjunto de moléculas involucradas en la fusión de los pliegues neurales son las moléculas de efrina y sus receptores Eph, que se adhieren de manera similar a las moléculas de cadherina analizadas anteriormente. [8]
La fusión de los pliegues neurales da lugar a muchas estructuras, incluido el tubo neural (el precursor del sistema nervioso central ), las células de la cresta neural (que dan lugar a una variedad de células mesenquimales diversas ) y la verdadera capa epidérmica . [1] El pliegue neural es una estructura extremadamente importante ya que este mecanismo es necesario para producir estos diversos tipos de células en los lugares correctos.

Existen muchas enfermedades potenciales que pueden surgir de la adhesión o fusión inadecuada de los pliegues neurales. Durante el plegamiento, las aberturas que se forman en las regiones craneal y caudal se denominan neuroporos craneal y caudal. [12] Si el neuroporo caudal no se cierra, puede producirse una afección llamada espina bífida , en la que la parte inferior de la médula espinal queda expuesta. A menudo, esta afección se puede detectar durante los exámenes prenatales y se puede tratar antes del nacimiento, aunque en los casos más graves, la persona puede afrontar la afección durante el resto de su vida. [13] Según la gravedad y el área afectada, las personas pueden experimentar una variedad de síntomas, incluida una función motora y movilidad variables, control de la vejiga y/o función sexual. [14]
Si, en cambio, la falla se encuentra en el neuroporo craneal, se produce anencefalia . En esta afección, el tejido cerebral queda expuesto directamente al líquido amniótico y, posteriormente, se degrada. [15] Si no se cierra todo el tubo neural, la afección se denomina craneorraquisquisis .
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )