Un nanogel es una partícula de hidrogel reticulada a base de polímero en la escala submicrónica . [1] [2] [3] Estas complejas redes de polímeros presentan una oportunidad única en el campo de la administración de fármacos en la intersección de nanopartículas y síntesis de hidrogeles. [1] [2] [3] Los nanogeles pueden ser naturales, sintéticos o una combinación de ambos y tienen un alto grado de sintonizabilidad en términos de tamaño, forma, funcionalización de la superficie y mecanismos de degradación. [1] [2] [3] Dadas estas características inherentes, además de su biocompatibilidad y capacidad para encapsular pequeños medicamentos y moléculas, los nanogeles son una estrategia prometedora para tratar enfermedades y disfunciones al servir como vehículos de administración capaces de atravesar barreras fisiológicas desafiantes dentro de el cuerpo. [1] [2] [3]
Los nanogeles no deben confundirse con el aerogel Nanogel , un aislante térmico liviano, o con los hidrogeles nanocompuestos (geles NC) , que son redes poliméricas hidratadas y rellenas de nanomateriales que exhiben mayor elasticidad y resistencia en comparación con los hidrogeles fabricados tradicionalmente.
La síntesis de nanogeles se puede lograr mediante una amplia gama de métodos diferentes. Sin embargo, dos pasos críticos que normalmente se incluyen en cada método son la polimerización y la reticulación, siendo la reticulación física y química la más común. [4] Estos pasos se pueden completar de forma concomitante o en orden secuencial dependiendo del método de síntesis y la eventual aplicación del nanogel. [4] Aquí se describen brevemente varios mecanismos de síntesis diferentes.

En la desolvatación o coacervación, se añade un no disolvente a una solución polimérica homogénea para producir complejos poliméricos individuales de tamaño nanométrico dispersos en la misma solución. [3] Estos complejos luego se reticulan para formar nanogeles y la funcionalización de la superficie es el siguiente paso opcional. [3]
En la precipitación, se añaden iniciadores y agentes reticulantes a una solución de monómero homogénea para inducir una reacción de polimerización. [4] Cuando la cadena polimérica alcanza la longitud deseada, la reacción se detiene y se forma una suspensión coloidal de polímero. [2] [3] Los tensioactivos son la adición final para producir polímeros de tamaño nanométrico. [2] [3]
Las interacciones electrostáticas pueden formar nanogeles mediante la combinación de polímeros aniónicos y catiónicos en una solución acuosa. [3] El tamaño y la carga superficial de los nanogeles resultantes se pueden modular cambiando el peso molecular o la relación de carga de los dos polímeros diferentes. [3] La gelificación ionotrópica también puede aprovechar las interacciones electrostáticas entre aniones y cationes multivalentes para formar nanogeles. [3]
Las interacciones hidrofóbicas dependen en gran medida de la reticulación física para formar nanogeles. [3] En este método, se añaden grupos hidrófobos a polímeros hidrófilos en una solución acuosa para inducir su autoensamblaje en nanogeles. [3] Cuando se utilizan polímeros tiolados ( tiomeros ) para este proceso de preparación, los nanogeles se pueden estabilizar aún más mediante la formación de enlaces disulfuro entre cadenas e intracadenas debido a la oxidación . En lo sucesivo incluso se pueden eliminar los oligopolímeros o polímeros con cargas opuestas. [5] [6]
La emulsión inversa, o miniemulsión inversa, requiere un disolvente orgánico y un tensioactivo o agente emulsionante. [3] [4] Se producen gotas de tamaño nanométrico cuando una solución acuosa de monómero se dispersa en el disolvente orgánico en presencia del tensioactivo o agente emulsionante. [3] [4] Tras la eliminación del disolvente orgánico y una mayor reticulación química y física de las gotas, se forman nanogeles. [3] [4] El tamaño de los nanogeles sintetizados mediante este método puede variar mucho según el tipo de tensioactivo y medio de reacción utilizado. [3] La purificación de nanogeles producidos utilizando un agente emulsionante también puede representar un desafío. [3]
La adición de una solución precursora de monómero y un agente reticulante a una microplantilla o dispositivo tipo molde puede iniciar la polimerización y la formación de nanogeles. [4] Este método se puede utilizar para crear nanogeles en formas específicas y cargarlos con varias moléculas pequeñas. [4] La polimerización de microplantillas litográficas es un proceso similar que utiliza un fotoiniciador y luz para desencadenar la formación de nanogeles. [4] La polimerización de microplantillas litográficas puede producir nanogeles más pequeños en una escala de longitud de <200 nm, que tiene una resolución más alta en comparación con la polimerización de microplantillas que no requiere un fotoiniciador. [4]
Las micelas basadas en polímeros que sufren reacciones de reticulación pueden inducir la formación de nanogeles. [3] [7] La reticulación del núcleo o la capa de micelas preexistentes puede sintetizar nanogeles con un "alto grado de organización espacial". [3] [7]
Dado que la biodegradabilidad es una característica importante de los nanogeles, estos hidrogeles suelen estar compuestos de polímeros sintéticos naturales o degradables. [3] Los polisacáridos y las proteínas dominan en gran medida las formas naturales de los polímeros utilizados para sintetizar nanogeles. [2] [3] Debido al uso de polisacáridos tiolados ( tiomeros ), como el quitosano tiolado o el ácido hialurónico tiolado [8] [9], los nanogeles se pueden estabilizar mediante enlaces disulfuro intra e intercaína. Las ventajas de los nanogeles a base de polímeros naturales incluyen la biocompatibilidad y la degradabilidad mediante mecanismos celulares in vivo. [3] Los polímeros naturales también tienden a ser no tóxicos y bioactivos, por lo que es más probable que induzcan señales biológicas que gobiernan diversos aspectos del comportamiento celular. [3] Sin embargo, los polímeros de base natural aún pueden causar una respuesta inmune y poseen otras desventajas, como tasas de degradación variables y estructuras heterogéneas. [3] Por el contrario, los polímeros de base sintética tienen estructuras más definidas, mayor estabilidad y tasas de degradación controladas. [3] En comparación con los polímeros de base natural, los polímeros sintéticos carecen de señales biológicas que pueden ser necesarias para aplicaciones terapéuticas específicas. [3] Dado que los polímeros naturales y sintéticos se definen por su propio conjunto de ventajas y desventajas, un área de investigación en curso tiene como objetivo crear hidrogeles compuestos para la síntesis de nanogeles que combinen polímeros sintéticos y naturales para aprovechar los beneficios de ambos en una sola formulación de nanogel. [3]

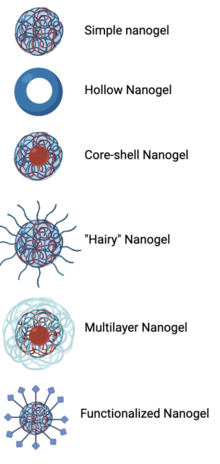
La estructura de un nanogel depende del mecanismo de síntesis y su aplicación. Los nanogeles simples o tradicionales son redes de polímeros reticulados del tamaño de nanopartículas que se hinchan en agua. [3] [10] Los nanogeles huecos que constan únicamente de una capa exterior pueden aumentar la cantidad de carga cargada en la plataforma. [3] [10] En otras estructuras de nanogel, el núcleo interno y la capa externa pueden estar hechos de dos materiales diferentes, como un núcleo interno hidrofóbico para rodear medicamentos u otras moléculas pequeñas y una capa externa hidrofílica que interactúa con el ambiente externo. [2] [3] La adición de un segundo monómero lineal reticulado a un nanogel se considera un "nanogel peludo". [2] [7] Se pueden completar diferentes métodos de síntesis de nanogeles en orden secuencial para crear nanogeles multicapa, como comenzar con gelificación ionotrópica y luego combinar polímeros aniónicos y catiónicos en una solución acuosa. [7] [10] Los nanogeles funcionalizados, en los que los ligandos dirigidos o los grupos funcionales sensibles a estímulos se conjugan con la capa exterior de un nanogel, también son importantes para ciertas aplicaciones de nanogel. [2] [3] [7] [10]
Los nanogeles se pueden diseñar para responder a diversos estímulos, incluidos cambios de pH y temperatura o la presencia de señales redox y luminosas. Se pueden aprovechar nanogeles que responden a estímulos cuidadosamente diseñados para transportar y liberar diferentes tipos de carga a tejidos específicos dentro del cuerpo con una resolución espaciotemporal creciente.

Los nanogeles sensibles al pH son una forma atractiva de tecnología de nanogeles debido a los diferentes niveles de pH que se encuentran dentro del cuerpo. Los tejidos sanos exhiben un pH de 7,4, mientras que los tumores pueden ser tan bajos como 6,5 y el estómago tan bajo como 1,0. [10] La protonación o desprotonación de ciertos grupos funcionales puede cambiar la velocidad de hinchamiento y la estabilidad de un nanogel, lo que resulta en la liberación de carga encapsulada cuando se expone a diferentes rangos de pH. [2] [10] Por ejemplo, los nanogeles aniónicos con grupos de ácido carboxílico colapsarán al exponerse a un pH que es menor que el pKa del polímero de nanogel. [2] [10] De manera similar, los nanogeles catiónicos con grupos amino terminales se protonarán si el pH del medio ambiente es menor que el pKa del hidrogel. [2] [10] En este caso, la tasa de hinchamiento del nanogel cambiará y se volverá más hidrófilo. [2] [10] Otros grupos también han entrecruzado previamente enlaces de hidrazona sensibles al pH con nanogeles basados en polisacáridos que liberaban una carga útil en un ambiente ácido. [11]
El uso de polímeros termosensibles en la síntesis de nanogeles permite que estos sistemas respondan a los cambios de temperatura. [1] Dependiendo de los grupos químicos presentes, los polímeros termosensibles pueden responder a una disminución o a un aumento de la temperatura. [10] Tanto los grupos hidrófobos como los hidrófilos suelen estar presentes en nanogeles poliméricos termosensibles que reaccionan a las disminuciones de temperatura, mientras que los nanogeles que responden a los aumentos de temperatura a menudo deben prepararse mediante una técnica de capas con enlaces de hidrógeno. [10] Los nanogeles sensibles a la temperatura son una estrategia potencial cuando una terapia se dirige a la piel, que tiene un gradiente de temperatura natural, o una región que experimenta inflamación. [1] [2] [10]
Los nanogeles que responden a redox generalmente contienen reticulaciones formadas por enlaces disulfuro [12] o agentes reticulantes específicos. [3] [10] También se pueden utilizar nanogeles hechos de monómeros biorreducibles y bifuncionales. En presencia de agentes reductores como el glutatión, la tiorredoxina y la peroxiredoxina, estos nanogeles responden liberando su carga. [10] [13] Dado que estos agentes reductores y varios otros se encuentran en concentraciones mayores dentro de las células en comparación con su entorno externo, los nanogeles con respuesta redox son una estrategia prometedora para la administración intracelular dirigida. [10]
Los nanogeles sensibles a la luz pueden activarse para liberar su carga al exponerlos a la luz en una determinada longitud de onda. [10] Estos nanogeles se sintetizan para contener enlaces acrílicos o a base de cumarina específicos que se escinden durante una fotorreacción. [10] Con la capacidad de ajuste de la longitud de onda de la luz, la energía y el tiempo de irradiación, se puede provocar que los nanogeles sensibles a la luz se degraden con un mayor control sobre la densidad de reticulación. [10] Por ejemplo, se descubrió que tanto la hinchazón como el tamaño de los nanogeles sensibles a la luz con grupos vinilo disminuyen y producen una liberación sostenida de fármacos después de la irradiación con luz ultravioleta. [10]

Una preocupación importante con cualquier forma de sistema de administración de fármacos, incluidos los nanogeles, son los posibles efectos secundarios y daños al tejido sano, además de provocar una respuesta inmunitaria negativa con la introducción de una sustancia extraña. [3] [7] Esto debe equilibrarse con la necesidad de que los nanogeles permanezcan en circulación durante un período adecuado para entregar la carga y producir un efecto terapéutico. [3] [7] Para combatir una respuesta inmune significativa, los nanogeles degradables son el valor predeterminado típico, ya que se consideran menos tóxicos en comparación con los nanogeles no degradables. [3] [7] La flexibilidad y el pequeño tamaño de los nanogeles degradables también les permite viajar a través de los vasos sanguíneos y alcanzar su área objetivo antes de ser consumidos por las células inmunes o filtrados por el hígado y el bazo. [3] [7]
Una vez que los nanogeles salen de la vasculatura, se difunden a través del espacio intersticial hacia el tejido objetivo. [7] A nivel celular, los nanogeles pueden internalizarse mediante una gran cantidad de tipos diferentes de endocitosis que dependen del tamaño, la forma y las propiedades de la superficie de la partícula. [3] [7] La endocitosis es el mecanismo más común que comienza con los nanogeles envueltos por la membrana celular. [3] [7] Los nanogeles se transportan en vesículas intracelulares para su entrega a los endosomas que eventualmente se combinan con los lisosomas. [3] [7] Una vez que los lisosomas se liberan en el citosol de una célula, entregan su carga inmediatamente o se mueven al compartimento celular apropiado. [3] [7]
Las aplicaciones potenciales de los nanogeles incluyen agentes de administración de fármacos , [14] [15] [16] [17] agentes de contraste para imágenes médicas o trazadores de resonancia magnética 19 F , [18] nanoactuadores y sensores. [19]
En 2022, se prevén más de 1,9 millones de nuevos casos de cáncer solo en Estados Unidos. [20] Los nanogeles son una solución atractiva de administración de fármacos para aumentar tanto la eficacia de las terapias contra el cáncer como su localización en las células cancerosas. Actualmente se están investigando nanogeles para el tratamiento de diferentes tipos de cáncer, de los cuales se enumeran aquí algunos ejemplos.
En un estudio, los nanogeles a base de quitosano cargados con doxorrubicina, un quimioterapéutico, con una carga superficial positiva demostraron una menor viabilidad de las células de cáncer colorrectal en comparación con los grupos de control y un nanogel cargado de manera similar con una carga superficial negativa. [21] Otro grupo conjugó ácido fólico con nanogeles cargados con cisplatino o doxorrubicina y administró estos tratamientos a las células de cáncer de ovario, que sobreexpresan el receptor de folato que se une al ácido fólico. [22] Estos nanogeles conjugados produjeron una disminución significativa en el crecimiento tumoral en un modelo de ratón en comparación con los controles de vehículo y mostraron un modelo de administración de sitio específico para nanogeles que puede ser efectivo para otros tipos de cáncer con receptores de folato regulados positivamente. [22] Curiosamente, se ha informado que los nanogeles a base de gelatina cargados con cisplatino y conjugados con ligandos del receptor del factor de crecimiento epidérmico (EGFR) atacan con éxito las células de cáncer de pulmón tanto in vitro como in vivo, y trabajos adicionales confirman la eficacia de estos nanogeles cuando se transforman. en partículas de aerosol. [23]

Los nanogeles son portadores ventajosos de pequeñas moléculas basadas en ácidos nucleicos que pueden emplearse para tratar una variedad de enfermedades. Aquí se analizan ejemplos de tres tipos diferentes de moléculas que entran en esta categoría: oligonucleótidos, miARN y análogos de nucleósidos.
En un estudio, se sintetizaron nanogeles sintéticos catiónicos modificados con insulina y transferrina para transportar oligonucleótidos, una posible herramienta terapéutica y de diagnóstico para los trastornos neurodegenerativos, al cerebro. [25] Estos nanogeles se localizaron con éxito a través de un modelo in vitro de la barrera hematoencefálica y se acumularon en el cerebro en un modelo de ratón. [25] Con el tratamiento de enfermedades cardiovasculares en mente, se han funcionalizado nanogeles a base de polisacáridos con fucoidan para apuntar a los receptores de selectina P sobreexpresados en plaquetas y células endoteliales. [26] Después de cargarlos con miARN, estos nanogeles se unieron a las plaquetas y fueron internalizados por una línea celular endotelial. [26] Los nanogeles también se han utilizado para encapsular análogos de nucleósidos fosforilados o formas activas de terapias contra el cáncer. En un estudio, los nanogeles cargados con nucleósidos 5'-trifosfatos sufrieron modificaciones en la superficie y se unieron con éxito a receptores de folato sobreexpresados en células de cáncer de mama. [27] Estos nanogeles luego fueron internalizados por las células y produjeron un aumento significativo en la citotoxicidad en comparación con los grupos de control. [27]
Los nanogeles que responden a diversos estímulos, incluidos cambios de pH y temperatura o la presencia de señales redox y luminosas, han demostrado ser herramientas útiles para la administración de fármacos. Uno de estos nanogeles sensibles fue diseñado para cambiar de una carga superficial negativa a una carga superficial positiva al exponerse a una disminución del pH una vez dentro de un tumor. [28] Cuando se cargó con un agente quimioterapéutico, esta tecnología indujo una menor viabilidad en esferoides tumorales 3D en comparación con los grupos de control. [28] Se descubrió que otro tipo de nanogel cargado con medicamentos antiinflamatorios para la osteoartritis aumenta significativamente la cantidad de medicamento transportado después de la aplicación tópica en la piel y la exposición a su temperatura elevada natural. [29] Un grupo informó sobre un método para controlar la tasa de liberación de un medicamento antiplaquetario a partir de un nanogel mediante el uso de luz ultravioleta para alterar la densidad de reticulación del polímero y posteriormente cambiar la tasa de hinchazón. [30] Además, se han sintetizado otros nanogeles para incluir polímeros escindibles por disulfuro que responden a señales reductoras en el entorno circundante. [31] Uno de esos nanogeles se cargó con un agente quimioterapéutico y demostró una disminución en la viabilidad celular en comparación con una versión libre del mismo agente. [31]
Además de las aplicaciones de administración de fármacos, los nanogeles se han utilizado como un tipo de modalidad de obtención de imágenes, ya que pueden encapsular pequeños tintes y otras moléculas informadoras. [7]

Los agentes de contraste típicos para resonancias magnéticas que contienen gadolinio y manganeso se excretan rápidamente del cuerpo y conllevan riesgos de mayor toxicidad. [33] [34] Los nanogeles tienen como objetivo eludir estas limitaciones encapsulando estos agentes y aumentando su relaxividad o sensibilidad. [7] [35] Un estudio encapsuló gadolinio-III dentro de un nanogel y observó una mejora significativa en la relajación en comparación con una formulación clínicamente disponible de gadolinio-III. [36] Otro grupo desarrolló nanogeles sensibles al pH que contienen nanopartículas de óxido de manganeso y óxido de hierro superparamagnético que obtuvieron imágenes con éxito de tumores pequeños, donde el pH era más ácido en comparación con los tejidos sanos circundantes. [32] Los nanogeles que contienen flúor también se pueden usar como trazadores para 19 F MRI , porque su agregación y unión al tejido tiene solo un efecto menor en su señal de 19 F MRI. Además, pueden transportar fármacos y las propiedades fisicoquímicas de los polímeros pueden modularse en gran medida. [18] [37] [38]
De manera similar a las imágenes por resonancia magnética, los radionucleidos metálicos se pueden cargar en nanogeles y entrecruzarlos para obtener radiotrazadores PET para imágenes. [7] [39] Los nanogeles que contienen isótopos de cobre comúnmente utilizados para imágenes PET demostraron estabilidad general y acumulación en los tumores, lo que produjo una señal más alta en comparación con el tejido cercano. [39] Otros estudios han explorado tecnologías similares con nanogeles con respuesta redox cargados con un isótopo de galio y otros metales trivalentes para imágenes PET. [40] También se han desarrollado nanogeles compuestos de dextrano para obtener imágenes de macrófagos asociados a tumores con radionúclidos y apuntar al hueso. [41] [42]
Para imágenes ópticas basadas en fluorescencia in vivo, los tintes que emiten longitudes de onda NIR >700 nm son los más efectivos, como el verde de indocianina, pero encuentran limitaciones con un tiempo de circulación reducido e interacciones no específicas con otros factores biológicos que afectan la fluorescencia. [7] Los nanogeles sensibles al pH con receptores de superficie funcionalizados para atacar las células cancerosas se cargaron con un tinte fluorescente que solo se liberaba tras la endocitosis. [43] Estos nanogeles generaron con éxito una señal fluorescente desde el interior de las células cancerosas y muchos otros grupos han desarrollado tecnologías similares. [7] [43]

Los nanogeles son una tecnología prometedora que se está explorando para ayudar en el proceso de curación de heridas. [44] Dada su capacidad para encapsular varios tipos de carga, los nanogeles pueden administrar estratégicamente agentes antiinflamatorios, medicamentos antimicrobianos y factores de crecimiento necesarios para facilitar el crecimiento de nuevos tejidos y la formación de vasos sanguíneos. [44] Los nanogeles a base de quitosano han demostrado un efecto mejorado de curación de heridas en estudios previos. [44] [45] [46] Los nanogeles a base de quitosano que encapsulan la interleucina-2 se utilizaron con éxito para estimular el sistema inmunológico y avanzar en el proceso de curación de heridas. [45] Además, en un estudio in vivo se descubrió que los nanogeles a base de quitosano que contienen un antibiótico, la sulfadiazina de plata, disminuyen el tamaño de las quemaduras de segundo grado. [46] En otro estudio, se sintetizaron nanogeles cargados de plata en una solución a base de polímero natural que contenía aloe vera, y la presencia de aloe vera condujo a una mayor curación y una disminución en el tamaño de la herida. [47] Con el objetivo de prevenir infecciones y acelerar el proceso de curación, un grupo también ha publicado un nuevo diseño de nanogel que consiste en un núcleo encapsulante y una superficie exterior funcionalizada capaz de atacar las bacterias presentes en las heridas. [48]
Para reparar y regenerar el tejido dañado, se han explorado los nanogeles no sólo para encapsular fármacos y factores de crecimiento para la administración local, sino también para que sirvan como estructuras porosas en un sitio de implantación de tejido. [44] Los nanogeles que contienen boro y sensibles a la temperatura formaron una estructura sólida tras la inyección en un defecto óseo crítico y continuaron induciendo la producción de nuevas células de osteoblastos. [49] Para tratar los efectos del infarto de miocardio, un estudio in vivo cargó nanogeles sensibles a la temperatura con células madre cardíacas y observó una mejor función cardíaca a través de un aumento en la eyección del ventrículo izquierdo. [50] Los vasos sanguíneos se han regenerado con éxito en un modelo in vivo de isquemia utilizando nanogeles para encapsular factores de crecimiento endotelial vascular. [51] Los nanogeles a base de heparina cargados con factores de crecimiento también se han probado en la regeneración del músculo uretral que causa la incontinencia urinaria. [52]
Se desarrolló un termómetro de nanogel fluorescente para medir temperaturas con un margen de error de 0,5 °C (0,90 °F) en células vivas. La célula absorbe agua cuando está más fría y la exprime a medida que aumenta su temperatura interna; la cantidad relativa de agua enmascara o expone la fluorescencia del nanogel. [53]