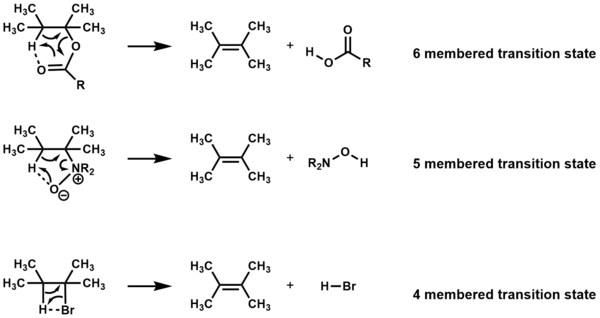
En química orgánica , el mecanismo E i ( eliminación interna/intramolecular ), también conocido como eliminación sin térmica o eliminación sin pericíclica , es un tipo especial de reacción de eliminación en la que dos sustituyentes vecinales (adyacentes) en una estructura de alcano salen simultáneamente a través de un estado de transición cíclico para formar un alqueno en una eliminación sin . [1] Este tipo de eliminación es único porque se activa térmicamente y no requiere reactivos adicionales, a diferencia de las eliminaciones regulares, que requieren un ácido o una base , o en muchos casos implicarían intermediarios cargados . Este mecanismo de reacción se encuentra a menudo en la pirólisis .
Los compuestos que sufren eliminación a través de estados de transición cíclicos al calentarse, sin otros reactivos presentes, reciben la designación de reacciones E i . Dependiendo del compuesto, la eliminación se produce mediante un estado de transición de cuatro, cinco o seis miembros. [1] [2]
La eliminación debe ser sin y los átomos coplanares para estados de transición de cuatro y cinco miembros, [3] pero no se requiere coplanaridad para estados de transición de seis miembros. [1]
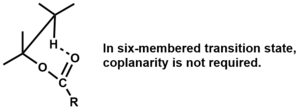
Existe una cantidad sustancial de evidencia que respalda la existencia del mecanismo E i , como por ejemplo: 1) se encontró que la cinética de las reacciones era de primer orden, [4] 2) el uso de inhibidores de radicales libres no afectó la velocidad de las reacciones, lo que indica que no están involucrados mecanismos de radicales libres [5] [6] 3) los estudios de isótopos para la eliminación de Cope indican que los enlaces CH y CN están parcialmente rotos en el estado de transición, [7] esto también está respaldado por cálculos que muestran un alargamiento de los enlaces en el estado de transición [8] y 4) sin la intervención de otros mecanismos, el mecanismo E i produce exclusivamente productos de eliminación syn.
Hay muchos factores que afectan la composición del producto de las reacciones Ei , pero típicamente siguen la regla de Hofmann y pierden un β-hidrógeno de la posición menos sustituida, dando lugar al alqueno menos sustituido (lo opuesto a la regla de Zaitsev ). [1] Algunos factores que afectan la composición del producto incluyen efectos estéricos , conjugación y estabilidad del alqueno en formación.
Para sustratos acíclicos, el isómero Z suele ser el producto menor debido a la interacción desestabilizadora de gauche en el estado de transición, pero la selectividad no suele ser alta. [2]

La pirólisis de N,N -dimetil-2-fenilciclohexilamina-N-óxido muestra cómo los efectos conformacionales y la estabilidad del estado de transición afectan la composición del producto para sustratos cíclicos. [2]
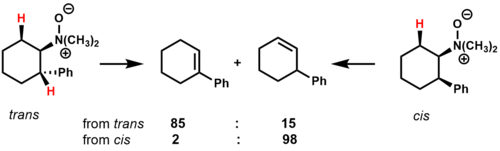
En el isómero trans , hay dos hidrógenos cis -β que pueden eliminarse. El producto principal es el alqueno que está conjugado con el anillo de fenilo, presumiblemente debido al efecto estabilizador sobre el estado de transición. En el isómero cis , sólo hay un hidrógeno cis - B que puede eliminarse, dando como producto principal el regioisómero no conjugado.
La descomposición pirolítica de ésteres es un ejemplo de eliminación térmica por síntesis . Cuando se someten a temperaturas superiores a 400 °C, los ésteres que contienen β-hidrógenos pueden eliminar un ácido carboxílico a través de un estado de transición de 6 miembros, lo que da como resultado un alqueno. [2] [6]

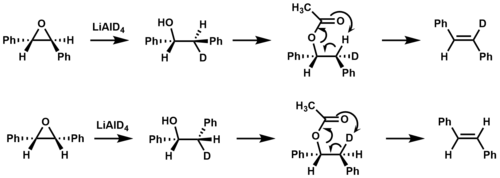
Se utilizó marcaje isotópico para confirmar que la eliminación de syn ocurre durante la pirólisis de éster en la formación de estilbeno . [9]
Se descubrió que los β-hidroxifenilsulfóxidos experimentan eliminación térmica a través de un estado de transición cíclico de 5 miembros, produciendo β-cetoésteres y metilcetonas después de la tautomerización y un ácido sulfénico . [10]

Los alcoholes alílicos se pueden formar a partir de β-hidroxifenilsulfóxidos que contienen un β'-hidrógeno a través de un mecanismo E i , que tiende a dar la β,γ- insaturación . [11]

Se descubrió que se formaban 1,3-dienos tras el tratamiento de un alcohol alílico con un sulfuro de arilo en presencia de trietilamina . [12] Inicialmente, se forma un éster de sulfenato seguido de una transposición [2,3]-sigmatrópica para producir un sulfóxido alílico que se somete a eliminación térmica sin para producir el 1,3-dieno.

La eliminación de Chugaev es la pirólisis de un éster de xantato , dando como resultado una olefina . [1] [13] Para formar el éster de xantato, un alcohol reacciona con disulfuro de carbono en presencia de una base, lo que da como resultado un xantato de metal que queda atrapado con un agente alquilante (típicamente yoduro de metilo ). La olefina se forma mediante la eliminación térmica por síntesis del β-hidrógeno y el éster xantato. La reacción es irreversible porque los subproductos resultantes, sulfuro de carbonilo y metanotiol , son muy estables.

La eliminación de Chugaev es muy similar a la pirólisis de éster, pero requiere temperaturas significativamente más bajas para lograr la eliminación, lo que la hace valiosa para sustratos propensos a la reordenación .
La deshidratación de alcoholes secundarios y terciarios para producir una olefina a través de un intermedio éster sulfamato se denomina reacción de deshidratación de Burgess . [13] [14] [15] Las condiciones de reacción utilizadas suelen ser muy suaves, lo que le otorga cierta ventaja sobre otros métodos de deshidratación para sustratos sensibles. Esta reacción se utilizó durante la primera síntesis total de taxol para instalar un grupo exometileno en el anillo C. [dieciséis]

Primero, el alcohol desplaza la trietilamina en el reactivo de Burgess , formando el intermedio éster sulfamato. La abstracción de β-hidrógeno y la eliminación del éster sulfamato a través de un estado de transición cíclico de 6 miembros produce el alqueno.
Los tiosulfinatos pueden eliminarse de forma análoga a los sulfóxidos. Representativa es la fragmentación de la alicina a tioacroleína, que pasará a formar vinilditiínas . Estas reacciones son importantes en la química antioxidante del ajo y otras plantas del género Allium .

La eliminación de selenóxido se ha utilizado para convertir cetonas, ésteres y aldehídos en sus derivados α,β-insaturados. [1] [17]

El mecanismo para esta reacción es análogo a la eliminación de sulfóxido, que es una eliminación térmica sin a través de un estado de transición cíclico de 5 miembros. Se prefieren los selenóxidos para este tipo de transformación a los sulfóxidos debido a su mayor reactividad hacia la β-eliminación, permitiendo en algunos casos que la eliminación tenga lugar a temperatura ambiente. [2]
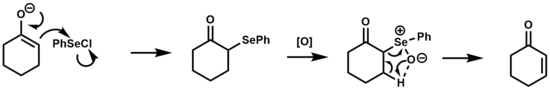
El ácido areneselénico generado después de la etapa de eliminación está en equilibrio con el diseleniuro de difenilo que puede reaccionar con olefinas para producir β-hidroxi seleniuros en condiciones ácidas o neutras. En condiciones básicas, esta reacción secundaria se suprime. [18]
La deshidratación en un solo recipiente de un alcohol primario para dar un alqueno a través de un intermedio de selenóxido de o -nitrofenilo se denomina eliminación de Grieco . [19] [20]

La reacción comienza con la formación de una sal de selenofosfonio que reacciona con el alcohol para formar una sal de oxafosfonio. El anión aril selenio desplaza el óxido de tributilfosfina formando la especie alquilaril seleniuro. Luego, el seleniuro se trata con un exceso de peróxido de hidrógeno, lo que da como resultado el selenóxido que elimina el β-hidrógeno a través de un estado de transición cíclico de 5 miembros, produciendo un alqueno.
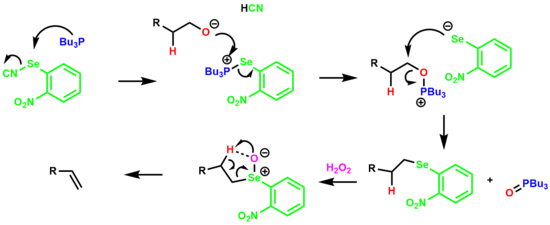
Se descubrió que el grupo nitro aceptor de electrones aumenta tanto la velocidad de eliminación como el rendimiento final de la olefina.
La eliminación de Cope (reacción de Cope) es la eliminación de un óxido de amina terciaria para producir un alqueno y una hidroxilamina mediante un mecanismo E i . [13] [21] La eliminación de Cope se utilizó en la síntesis de un imitador de manopiranosilamina. [22] La amina terciaria se oxidó al óxido de amina usando ácido m -cloroperoxibenzoico ( m CPBA) y se sometió a altas temperaturas para la eliminación térmica del β-hidrógeno y el óxido de amina a través de un estado de transición cíclico, produciendo el alqueno. Vale la pena señalar que el hidrógeno indicado (en verde) es el único hidrógeno disponible para la eliminación de síntesis .

Los óxidos de amina cíclica (anillos que contienen nitrógeno de 5, 7 a 10 miembros) también pueden sufrir eliminación sintética interna para producir hidroxilaminas acíclicas que contienen alquenos terminales. [13]
El mecanismo para la eliminación de Hofmann es generalmente E2 , pero puede pasar por una vía Ei en determinadas circunstancias. Para algunas moléculas estéricamente impedidas, la base desprotona un grupo metilo en la amina en lugar del β-hidrógeno directamente, formando un intermedio de iluro que elimina la trimetilamina a través de un estado de transición de 5 miembros, formando el alqueno. Los estudios de etiquetado de deuterio confirmaron este mecanismo al observar la formación de trimetilamina deuterada (y no de agua deuterada, que se formaría a partir del mecanismo E2). [23]
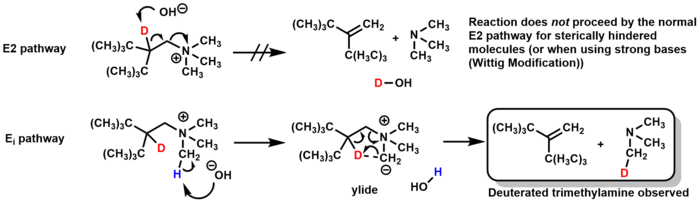
La eliminación de Hofmann modificada por Wittig pasa por el mismo mecanismo E i , pero en lugar de usar óxido de plata y agua como base, la modificación de Wittig usa bases fuertes como alquilitios o KNH2/NH3 líquido. [24] [25]
Se descubrió que los yoduros de alquilo secundarios y terciarios con grupos fuertemente aceptores de electrones en el carbono α experimentaban una eliminación sin pericíclica cuando se exponen al ácido m -cloroperbenzoico ( m CPBA). [26] Se propone que la reacción pase por un intermedio yodoso antes de la eliminación sinérgica del ácido hipoyodoso .

El alcance de esta reacción no incluye yoduros de alquilo primarios porque el intermedio yodoso se reorganiza en el intermedio hipoyodito, que, bajo las condiciones de reacción, se convierte en un alcohol. Los grupos fuertemente aceptores de electrones suprimen la vía de reordenamiento, permitiendo que predomine la vía de eliminación pericíclica syn .