
Las poblaciones subrepresentadas , especialmente las poblaciones negras e hispanas con fibrosis quística , a menudo no reciben un diagnóstico exitoso. [1] Esto se debe en parte a la mínima difusión de los datos existentes sobre los pacientes de estos grupos subrepresentados. Si bien las poblaciones blancas parecen experimentar una mayor frecuencia de fibrosis quística, otras etnias también se ven afectadas y no siempre por los mismos mecanismos biológicos. [2] Por lo tanto, muchas opciones de atención médica y tratamiento son menos confiables o no están disponibles para las poblaciones subrepresentadas. Este problema afecta el nivel en el que se satisfacen las necesidades de salud pública en todo el mundo.
La fibrosis quística (FQ) es un trastorno autosómico recesivo y monogénico . Está causada por mutaciones en el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR ). [3] La proteína CFTR (Figura 1) sirve para mover iones de cloruro a la superficie de las células para asegurar una hidratación adecuada. Cuando esta proteína deja de funcionar, los iones de cloruro no están presentes para diluir la mucosidad viscosa que se forma. Esta mucosidad espesa causa muchos problemas en varios órganos del cuerpo. [4]

Las personas con fibrosis quística pueden experimentar piel salada, tos persistente, infecciones pulmonares como neumonía y bronquitis , y sibilancias y falta de aliento. La fibrosis quística también puede causar un aumento de peso y un crecimiento deficientes, pólipos nasales , infecciones crónicas de los senos nasales , hipocratismo o agrandamiento de los dedos de las manos y de los pies, infertilidad en los varones y prolapso rectal . [4] La fibrosis quística también puede provocar artropatías . [5] Estos síntomas y comorbilidades pueden, en última instancia, provocar déficits nutricionales y una calidad de vida muy reducida. [6]
En comparación con los pacientes blancos, los pacientes negros presentan hallazgos de imagen pulmonar más graves y presentan más síntomas respiratorios en el momento del diagnóstico. De manera similar, los pacientes negros e hispanos tienen una función pulmonar en general peor que los pacientes blancos, que suele presentarse en etapas más tempranas de la vida. [7] Aunque este puede ser el caso, estos síntomas pueden diagnosticarse erróneamente como otros problemas de salud y tratarse como tales. [8]
Para que se les diagnostique fibrosis quística, los pacientes deben cumplir ciertos criterios, entre los que se incluyen mostrar una combinación de los signos y síntomas anteriores y/o tener un familiar con fibrosis quística y/o dar positivo en la prueba de detección de la mutación durante el examen genético.
Los individuos deben tener al menos una característica clínica: [3]
O diagnóstico de fibrosis quística en un miembro de la familia, o prueba de detección del recién nacido positiva, más uno o ambos de los siguientes:
Aunque estos síntomas pueden presentarse en minorías subrepresentadas, sigue existiendo la idea errónea entre los médicos de que las minorías subrepresentadas rara vez padecen la enfermedad. [9] Esto da como resultado un infradiagnóstico en estas poblaciones. Además, en países en desarrollo, como en África, donde el VIH , la desnutrición proteico-energética [10] y las infecciones pulmonares crónicas son prominentes , puede ser difícil para los médicos diagnosticar correctamente a los pacientes con fibrosis quística. [1] [8] El diagnóstico adecuado también puede verse afectado cuando los pacientes muestran un resultado positivo en la prueba pero no presentan síntomas o presentan síntomas pero no muestran pruebas diagnósticas positivas. Por esta razón, es muy importante continuar monitoreando a los pacientes en ambas categorías, especialmente a los de esta última mientras se tratan los síntomas que pueden estar disfrazados de otra enfermedad. [3]
En muchos países occidentales, se dispone de pruebas genéticas prenatales y neonatales , lo que se ha correlacionado con una menor incidencia, ya que los pacientes y sus familias pueden buscar tratamiento de forma temprana. [3] [11] Estos métodos de detección pueden incluir la medición de la tripsina inmunorreactiva (iRT) sérica y el análisis de la mutación CFTR. [12] [13]
Los sistemas de clasificación de mutaciones de CFTR generalmente incluyen seis clases [14] donde las clases I a III tienden a tener síntomas más graves que las clases IV a VI. [1]
Los análisis de mutación de IRT y CFTR siempre se confirman con lo que se conoce como una prueba de sudor que mostrará niveles elevados de cloruro en el sudor de los pacientes con fibrosis quística. [3] [15] Sin embargo, este no es un sistema perfecto y muchos niños terminan con un diagnóstico no concluyente y necesitan ser monitoreados para detectar síntomas que pueden no aparecer hasta mucho más tarde en la vida. [16] Además, en algunos estados como Nueva Jersey , solo hay una mutación en el panel de detección de CFTR ( F508del ). Debido a que el 12,9% de los pacientes con fibrosis quística en los Estados Unidos no tienen esta mutación específica, no se les puede diagnosticar utilizando este método de detección en particular. Este valor puede ser incluso mayor cuando se limita a las poblaciones minoritarias (ver raza y etnia). [8] [17] Tras el análisis del Registro de Pacientes de la Fundación de Fibrosis Quística de 2020 , la tasa de detección de variantes de mutación de CFTR en pacientes con fibrosis quística conocidos fue más alta en pacientes blancos con una tasa de falsos negativos de solo el 3-5%. [11]
Dado que la mutación CFTR es autosómica recesiva, el factor de riesgo más importante es el historial familiar. La enfermedad solo se manifiesta cuando un niño hereda mutaciones CFTR de ambos padres. Los niños que heredan una mutación de uno de los padres se consideran portadores y pueden transmitirla a sus hijos. [4] Siendo este el caso, las mutaciones pueden ser específicas de la familia y la región (ver Raza, etnia y ubicación geográfica). [17] Con respecto al sexo, la fibrosis quística se presenta en hombres y mujeres; sin embargo, las mujeres tienen más probabilidades de presentar peores síntomas y resultados. [18] Esto es particularmente relevante con respecto a las infecciones respiratorias por Peudomonas aeruginosa [19] . [20] En cuanto a la edad, la mayoría de las personas son diagnosticadas a la edad de 2 años; sin embargo, el Registro de Pacientes de la Fundación de Fibrosis Quística muestra que más de la mitad de la población con fibrosis quística tiene 18 años o más en los Estados Unidos. [4]
La fibrosis quística se presenta en todas las razas, pero puede ser más frecuente en personas blancas de ascendencia del norte de Europa . [21] La incidencia de fibrosis quística en otras poblaciones puede estar subnotificada, ya que hay cientos de mutaciones del gen CFTR que pueden manifestar la enfermedad y no todas han sido identificadas. Aunque ha habido una disminución en la incidencia en los países más desarrollados debido al cribado genético prenatal, [22] [23] se espera que la prevalencia aumente a medida que las personas puedan vivir más tiempo con la enfermedad. [3]
F508del es la mutación más común en todos los pacientes con fibrosis quística. [24] Sin embargo, no es la mutación más común que se encuentra en ubicaciones geográficas específicas.
Dado que un método popular de identificación es la prueba genética para esta mutación particular, la frecuencia de identificación es menor en la población subrepresentada.
Los descendientes de africanos muestran la mayor diversidad genética de la población humana. Para los pacientes con fibrosis quística de ascendencia africana, esto significa que es más probable que presenten mutaciones CFTR menos comunes. [1] Algunas mutaciones exclusivas de África son 2766del8, 1670delC, Y1109x y A204T.
El tratamiento es más eficaz si se realiza un diagnóstico temprano. Como la fibrosis quística es una enfermedad complicada, los pacientes a menudo deben recurrir a una combinación de terapias. [4]
La limpieza de las vías respiratorias de la mucosidad puede ayudar a disminuir la incidencia de infecciones en los pulmones y mejorar la función pulmonar. Las técnicas más comunes de limpieza de las vías respiratorias incluyen la tos profunda, la terapia de respiración activa, el drenaje autógeno y la presión espiratoria positiva. [ cita requerida ]
Existen varios medicamentos inhalables disponibles, como broncodilatadores y antimucosos. Se trata de medicamentos que se administran en forma de vapor o aerosol y se inhalan a través de un nebulizador . También pueden incluir antibióticos . [ cita requerida ]

Los antibióticos se utilizan para combatir las infecciones bacterianas que los pacientes con fibrosis quística tienen muchas probabilidades de desarrollar debido al espesamiento de la mucosidad. Los pacientes con fibrosis quística suelen tomarlos a diario. Se recomienda que los antibióticos inhalados se tomen solo cuando las vías respiratorias estén despejadas para que el medicamento pueda llegar fácilmente a la zona afectada. [ cita requerida ]
Los suplementos de enzimas pancreáticas sirven para mejorar la función pancreática al aumentar la absorción de nutrientes esenciales . Se toman con las comidas. Los multivitamínicos como suplementos también se recomiendan para los pacientes con fibrosis quística. [25]
Un plan de acondicionamiento físico personalizado puede ayudar a limpiar las vías respiratorias, mejorar la energía, aumentar la función pulmonar y ayudar a la salud general del paciente. [26]
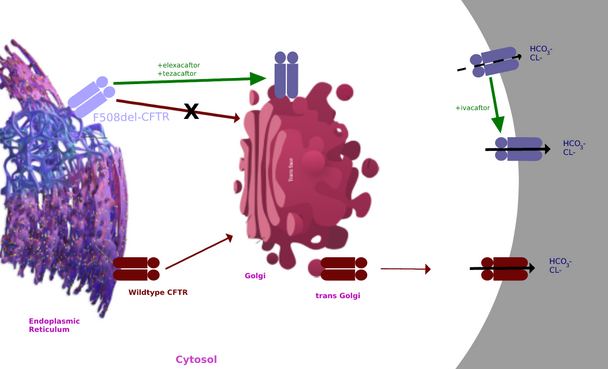
Los moduladores de CFTR se dirigen a la proteína CFTR mutada. [27] [28] Hasta el momento, existen algunos moduladores de CFTR aprobados para mutaciones específicas. Uno de estos fármacos es el elexacaftor/tezacaftor/ivacaftor . Sin embargo, el costo de los moduladores de CFTR es alto. [29] Además del alto costo, los moduladores de CFTR disponibles pueden no ser tan efectivos en poblaciones minoritarias. [30] De hecho, mientras que el 92,4% de los pacientes blancos son elegibles para el tratamiento con moduladores de CFTR, solo el 69,7% y el 75,6% de los pacientes hispanos son elegibles. [30]
Las comunidades con grandes poblaciones negras e hispanas también tienen más probabilidades de tener una atención médica de menor calidad/menor disponibilidad. [31] Esto significa que el riesgo de que se cometan errores en la detección y el diagnóstico es más probable en estas áreas. Las clínicas y los hospitales a menudo tienen poco personal y la prisa por procesar las muestras puede causar resultados de detección inexactos. [8] Además, las pruebas de detección de fibrosis quística para CFTR presentan resultados negativos falsos con mayor frecuencia en bebés negros e hispanos. [11] [32] Esto sucede porque las variantes de CFTR que más se analizan son las que se encuentran principalmente en las poblaciones blancas. [11] Además, como se mencionó anteriormente, uno de los métodos de diagnóstico más comunes es el uso de la prueba del sudor. Sin embargo, esta prueba tiene una tasa desproporcionada de falsos negativos en áreas con menos acceso a la atención médica. [11] [30] La presencia de sesgos implícitos en la atención médica también contribuye a esto. [7] [33] Además, la disponibilidad de opciones de detección genética en países en desarrollo y áreas de menor nivel socioeconómico ha demostrado ser difícil tanto por la carga financiera como por la carga de recursos. [34] En conjunto, esto significa que las familias negras e hispanas tienen más probabilidades de ser diagnosticadas más tarde y, por lo tanto, no reciben un tratamiento oportuno y tan eficaz. [ cita requerida ]
Todavía se debate si el pronóstico general de la fibrosis quística está mejorando. En las zonas donde se dispone de pruebas genéticas, los médicos pueden identificar y tratar la fibrosis quística de forma temprana. En las zonas donde no se dispone de ellas, muchos pacientes no reciben el diagnóstico hasta una edad más avanzada y presentan síntomas peores y un peor control de los síntomas. [35] Esto suele ocurrir en zonas donde hay una alta densidad de grupos subrepresentados. [36] Con el acceso reducido a la atención sanitaria, las poblaciones minoritarias experimentan peores resultados, incluso después de tener en cuenta el bajo nivel socioeconómico. [7] Aunque los pacientes hispanos tienen más probabilidades que los pacientes blancos de tener mutaciones CFTR más leves (las de las clases IV a VI), sufren peores resultados.
Además de centrarse en mejorar la detección y el diagnóstico, comprender los microorganismos de la fibrosis quística y desarrollar nuevos tratamientos, optimizar los tratamientos actuales y evaluar el uso de antimicrobianos a largo plazo, la Cystic Fibrosis Foundation está actualmente [ ¿cuándo? ] luchando por una mayor equidad y puntualidad en la detección de fibrosis quística en recién nacidos. [37] El Cystic Fibrosis Research Institute ha implementado estrategias para aumentar la concienciación en poblaciones subrepresentadas. [38] Aunque hay investigaciones en curso sobre la fibrosis quística en poblaciones subrepresentadas, muchos de los estudios dejan mucho que desear y no se realizan según los estándares de los estudios realizados en pacientes blancos. [ cita requerida ] [ editorialización ]