Los hidruros de metales de transición son compuestos químicos que contienen un metal de transición unido a hidrógeno . La mayoría de los metales de transición forman complejos de hidruro y algunos son importantes en diversas reacciones catalíticas y sintéticas. El término "hidruro" se utiliza de forma imprecisa: algunos de ellos son ácidos (p. ej., H 2 Fe(CO) 4 ), mientras que otros son hidrílicos, es decir, tienen un carácter similar al del H − (p. ej., ZnH 2 ).
Muchos metales de transición forman compuestos con hidrógeno. Estos materiales se denominan hidruros binarios, porque contienen solo dos elementos. Se supone que el ligando hidrogénico tiene carácter hidródico (similar al H − ). Estos compuestos son invariablemente insolubles en todos los disolventes, lo que refleja sus estructuras poliméricas. A menudo exhiben conductividad eléctrica similar a la de los metales. Muchos son compuestos no estequiométricos . Los metales electropositivos ( Ti , Zr , Hf , Zn ) y algunos otros metales forman hidruros con la estequiometría MH o, a veces, MH 2 (M = Ti , Zr , Hf, V, Zn ). Los mejor estudiados son los hidruros binarios de paladio , que forman fácilmente un monohidruro limitante. De hecho, el gas hidrógeno se difunde a través de las ventanas de Pd mediante la intermediación de PdH. [1]
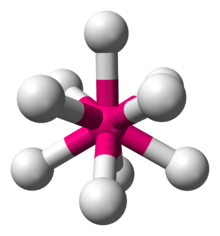
Los hidruros metálicos ternarios tienen la fórmula A x MH n , donde A + es un catión de metal alcalino o alcalinotérreo, p. ej. K + y Mg 2+ . Un ejemplo célebre es K 2 ReH 9 , una sal que contiene dos iones K + y el anión ReH 9 2− . Otros hidruros metálicos homolépticos incluyen los aniones en Mg 2 FeH 6 y Mg 2 NiH 4 . Algunos de estos polihidruros aniónicos satisfacen la regla de los 18 electrones , muchos no lo hacen. Debido a su alta energía reticular , estas sales normalmente no son solubles en ningún disolvente, siendo una excepción bien conocida el K 2 ReH 9 . [3]
Los hidruros más frecuentes de los metales de transición son complejos metálicos que contienen una mezcla de ligandos además del hidruro. La gama de coligandos es amplia. Prácticamente todos los metales forman derivados de este tipo. Las principales excepciones incluyen los metales tardíos plata, oro, cadmio y mercurio , que forman pocos complejos o complejos inestables con enlaces MH directos. Ejemplos de hidruros útiles industrialmente son HCo(CO) 4 y HRh(CO)(PPh 3 ) 3 , que son catalizadores para la hidroformilación .

Los primeros hidruros moleculares de los metales de transición fueron reportados por primera vez en la década de 1930 por Walter Hieber y colaboradores. Describieron H 2 Fe(CO) 4 y HCo(CO) 4 . Después de una pausa de varios años, y tras la publicación de documentos de guerra alemanes sobre el papel postulado del HCo(CO) 4 en la hidroformilación , varios hidruros nuevos fueron reportados a mediados de la década de 1950 por tres grupos prominentes en química organometálica: HRe(C 5 H 5 ) 2 por Geoffrey Wilkinson , HMo(C 5 H 5 )(CO) 3 por EO Fischer y HPtCl(PEt 3 ) 2 por Joseph Chatt . [4] Ahora se conocen miles de estos compuestos.
Al igual que los complejos de coordinación de hidruro, muchos grupos presentan ligandos hidruro terminales (unidos por un enlace M–H). Los ligandos hidruro también pueden unir pares de metales, como lo ilustra [HW 2 (CO) 10 ] − . El grupo H 2 Os 3 (CO) 10 presenta ligandos hidruro tanto terminales como de doble puente. Los hidruros también pueden abarcar la cara triangular de un grupo como en [Ag 3 {(PPh 2 ) 2 CH 2 } 3 (μ 3 -H)(μ 3 -Cl)]BF 4 . [5] En el grupo [Co 6 H(CO) 15 ] − , el hidruro es "intersticial", ocupando una posición en el centro del octaedro Co 6 . La asignación de hidruros en racimo puede ser un desafío, como lo ilustran los estudios sobre el reactivo de Stryker [Cu 6 (PPh 3 ) 6 H 6 ]. [6]
Los hidruros del grupo principal nucleófilo convierten muchos haluros y cationes de metales de transición en los hidruros correspondientes:
Estas conversiones son reacciones de metátesis y la hidricidad del producto es generalmente menor que la del donante de hidruro. Los reactivos donantes de hidruro clásicos (y relativamente baratos) incluyen borohidruro de sodio e hidruro de litio y aluminio . En el laboratorio, a menudo se ofrece un mayor control mediante "hidruros mixtos" como trietilborohidruro de litio y Red-Al . Los hidruros de metales alcalinos, por ejemplo, hidruro de sodio , no suelen ser reactivos útiles.
La eliminación de hidruros beta y la eliminación de hidruros alfa son procesos que producen hidruros. La primera es una vía de terminación común en la polimerización homogénea . También permite sintetizar algunos complejos de hidruros de metales de transición a partir de organolitio y reactivos de Grignard :
La adición oxidativa de dihidrógeno a un centro metálico de transición de baja valencia es común. Varios metales reaccionan directamente con H 2 , aunque normalmente se requiere calentar a unos pocos cientos de grados. Un ejemplo es el dihidruro de titanio , que se forma cuando la esponja de titanio se calienta a 400-700 °C bajo una atmósfera de hidrógeno. Estas reacciones suelen requerir metales de gran área superficial. La reacción directa de los metales con H 2 es un paso en la hidrogenación catalítica .
Para las soluciones, el ejemplo clásico es el complejo de Vaska : [7]
La adición oxidativa también puede ocurrir en complejos dimetálicos, por ejemplo:
Muchos ácidos participan en adiciones oxidativas, como lo ilustra la adición de HCl al complejo de Vaska:
Algunos hidruros metálicos se forman cuando un complejo metálico se trata con hidrógeno en presencia de una base. La reacción no implica cambios en el estado de oxidación del metal y puede considerarse como la división del H2 en hidruro (que se une al metal) y protón (que se une a la base).
Se supone que en estas reacciones intervienen complejos de dihidrógeno . Los catalizadores bifuncionales activan el H2 de esta manera.
Los valores cambian en <6 kJ/mol tras la sustitución de CO por un ligando de fosfina.
El enlace MH puede, en principio, escindirse para producir un protón, un radical hidrógeno o un hidruro. [9]
Aunque estas propiedades están interrelacionadas, no son interdependientes. Un hidruro metálico puede ser termodinámicamente un ácido débil y un donador de H − débil ; también podría ser fuerte en una categoría pero no en la otra o fuerte en ambas. La fuerza de H − de un hidruro, también conocida como su capacidad de donador de hidruro o hidricidad, corresponde a la fuerza de base de Lewis del hidruro. No todos los hidruros son bases de Lewis potentes. La fuerza de base de los hidruros varía tanto como el pKa de los protones. Esta hidricidad se puede medir mediante la escisión heterolítica del hidrógeno entre un complejo metálico y una base con un pKa conocido y luego midiendo el equilibrio resultante. Esto presupone que el hidruro no reacciona de forma heterolítica ni homolítica consigo mismo para reformar hidrógeno. Un complejo reaccionaría homolíticamente consigo mismo si el enlace MH homolítico vale menos de la mitad del enlace HH homolítico. Incluso si la fuerza del enlace homolítico está por encima de ese umbral, el complejo sigue siendo susceptible a las vías de reacción radicalaria.
Un complejo reaccionará heterolíticamente consigo mismo cuando sea simultáneamente un ácido fuerte y un hidruro fuerte. Esta conversión da como resultado una desproporción que produce un par de complejos con estados de oxidación que difieren en dos electrones. Son posibles otras reacciones electroquímicas .
Como se ha señalado, algunos complejos escinden heterolíticamente el dihidrógeno en presencia de una base. Una parte de estos complejos dan lugar a complejos de hidruro lo suficientemente ácidos como para que la base los desprotone una segunda vez. En esta situación, el complejo inicial puede reducirse en dos electrones con hidrógeno y base. Incluso si el hidruro no es lo suficientemente ácido como para ser desprotonado, puede reaccionar homolíticamente consigo mismo, como se ha explicado anteriormente, para una reducción total de un electrón.
La afinidad de un ligando hidruro por un ácido de Lewis se denomina hidricidad:
Como el hidruro no existe como anión estable en solución, esta constante de equilibrio (y su energía libre asociada) se calculan a partir de equilibrios mensurables. El punto de referencia es la hidricidad de un protón, que en solución de acetonitrilo se calcula en −76 kcal mol −1 : [10]
En relación con un protón, la mayoría de los cationes presentan una menor afinidad por el H − . Algunos ejemplos incluyen:
Estos datos sugieren que [HPt(dmpe) 2 ] + sería un fuerte donante de hidruro, lo que refleja la estabilidad relativamente alta de [Pt(dmpe) 2 ] 2+ . [11]
Las tasas de transferencia de protones hacia y entre complejos metálicos suelen ser lentas. [12] Muchos hidruros son inaccesibles para estudiar a través de ciclos termodinámicos de Bordwell . Como resultado, se emplean estudios cinéticos para dilucidar ambos parámetros termodinámicos relevantes. Generalmente, los hidruros derivados de metales de transición de primera fila muestran la cinética más rápida, seguidos de los complejos metálicos de segunda y tercera fila.
La determinación de las estructuras de los hidruros metálicos puede ser un desafío, ya que los ligandos de hidruro no dispersan bien los rayos X, especialmente en comparación con el metal unido. En consecuencia, las distancias de MH a menudo se subestiman, especialmente en los primeros estudios. A menudo, la presencia de un ligando de hidruro se dedujo por la ausencia de un ligando en un sitio de coordinación aparente. Clásicamente, las estructuras de los hidruros metálicos se abordaron mediante difracción de neutrones, ya que el hidrógeno dispersa fuertemente los neutrones. [13]
Los complejos metálicos que contienen hidruros terminales son comunes. En compuestos bi- y polinucleares, los hidruros suelen ser ligandos puente . De estos hidruros puente, muchos son oligoméricos, como el reactivo de Stryker . [14] [(Ph 3 P)CuH] 6 y grupos como [Rh 6 (PR 3 ) 6 H 12 ] 2+ . [15] El motivo de enlace final es el dihidruro no clásico también conocido como aductos de dihidrógeno con enlace sigma o simplemente complejos de dihidrógeno. El complejo [W(PR 3 ) 2 (CO) 3 (H 2 )] fue el primer ejemplo bien caracterizado tanto de un dihidruro no clásico como de un complejo con enlace sigma en general. [16] [17] La difracción de rayos X generalmente es insuficiente para localizar hidruros en estructuras cristalinas y, por lo tanto, se debe suponer su ubicación. Se requiere la difracción de neutrones para localizar de forma inequívoca un hidruro cerca de un átomo pesado mediante cristalografía. Los hidruros no clásicos también se han estudiado con una variedad de técnicas de RMN de temperatura variable y acoplamientos HD.
Los hidruros de metales de transición tardíos muestran de manera característica desplazamientos hacia arriba del campo en sus espectros de RMN de protones . Es común que la señal M- H aparezca entre δ-5 y -25 con muchos ejemplos fuera de este rango, pero generalmente todos aparecen por debajo de 0 ppm. Los grandes desplazamientos surgen de la influencia de los estados excitados y debido al fuerte acoplamiento espín-órbita [18] (en contraste, los desplazamientos de RMN de 1 H para compuestos orgánicos ocurren típicamente en el rango δ12-1). En un extremo está el complejo 16e IrHCl 2 (PMe( t -Bu) 2 ) 2 con un desplazamiento de -50,5. Las señales a menudo exhiben acoplamiento espín-espín con otros ligandos, por ejemplo, fosfinas. [19]
Los hidruros metálicos exhiben bandas IR cerca de 2000 cm −1 para ν M-H , aunque las intensidades son variables. [4] Estas señales se pueden identificar mediante el etiquetado con deuterio.
En 1844 se había descrito un hidruro de cobre poco definido como resultado del tratamiento de sales de cobre con ácido hipofosforoso . Posteriormente se descubrió que el gas hidrógeno era absorbido por mezclas de sales de metales de transición y reactivos de Grignard . [20]
El primer complejo hidruro metálico bien definido fue H 2 Fe(CO) 4 , obtenido por la protonación a baja temperatura de un anión carbonilo de hierro. El siguiente complejo hidruro reportado fue (C 5 H 5 ) 2 ReH. El último complejo fue caracterizado por espectroscopia de RMN , que demostró la utilidad de esta técnica en el estudio de complejos de hidruro metálico. [20] En 1957, Joseph Chatt, Bernard L. Shaw y LA Duncanson describieron trans -PtHCl(PEt 3 ) 2 el primer hidruro no organometálico (es decir, sin un enlace metal-carbono). Se demostró que era estable al aire, corrigiendo el prejuicio mantenido durante mucho tiempo de que los hidruros metálicos serían inestables. [21]