La tuyaplicina ( isopropil cicloheptatrienolona) es cualquiera de los tres productos naturales relacionados con la tropolona isoméricos que se han aislado de las maderas blandas de los árboles de la familia Cupressaceae . [1] Estos compuestos son conocidos por sus propiedades antibacterianas, antifúngicas y antioxidantes . [2] [3] Fueron las primeras tropolonas naturales que se fabricaron sintéticamente. [4]

Las tuyaplicinas se descubrieron a mediados de la década de 1930 y se purificaron del duramen de Thuja plicata Donn ex D. Don , comúnmente llamado cedro rojo occidental. [5] Estos compuestos también se identificaron en los componentes de Chamaecyparis obtusa , otra especie de la familia Cupressaceae . C. obtusa es originaria de países del este de Asia, incluidos Japón y Taiwán , y también se conoce como hinoki de Taiwán , de donde se aisló por primera vez la β-tuyaplicina en 1936 y recibió su nombre, hinokitiol . Las tuyaplicinas fueron las primeras tropolonas naturales que se fabricaron sintéticamente, por Ralph Raphael y colegas, y la β-tuyaplicina fue el primer compuesto aromático no bencenoide identificado, por Tetsuo Nozoe y colegas. [4] [5] La resistencia del duramen del árbol a la descomposición fue la principal razón que impulsó a investigar su contenido e identificar los compuestos responsables de las propiedades antimicrobianas. [4] La β-tuyaplicina ganó más interés científico a principios de la década de 2000. [6] Más tarde, se descubrió la actividad de unión al hierro de la β-tuyaplicina y la molécula ha sido apodada irónicamente como "molécula del Hombre de Hierro", [7] porque el primer nombre de Tetsuo Nozoe puede traducirse al inglés como "Hombre de Hierro". [6]
Las tjujaplicinas se encuentran en el duramen de los árboles de coníferas pertenecientes a la familia Cupressaceae , incluidos Chamaecyparis obtusa (ciprés Hinoki), Thuja plicata (cedro rojo occidental), Thujopsis dolabrata var. hondai (Hinoki asunaro), Juniperus cedrus (enebro de Canarias), Cedrus atlantica (cedro del Atlas), Cupressus lusitanica (cedro blanco mexicano), Chamaecyparis lawsoniana (cedro de Port Orford), Chamaecyparis taiwanensis (ciprés de Taiwán), Chamaecyparis thyoides ( cedro blanco del Atlántico), Cupressus arizonica (ciprés de Arizona), Cupressus macnabian a (ciprés de MacNab), Cupressus macrocarpa (ciprés de Monterrey), Juniperus chinensis (enebro chino), Juniperus communis (enebro común), Juniperus californica (enebro de California), Juniperus occidentalis (enebro occidental), Juniperus oxycedrus (Cade), Juniperus sabina (enebro de Savin), Calocedrus decurrens (cedro de incienso de California), Calocedrus formosana (cedro de incienso de Taiwán), Platycladus orientalis (tuya china), Thuja occidentalis (cedro blanco del norte), Thuja standishii (tuya japonesa), Tetraclinis articulata (Sandarac). [8] [9] [10] [11]
Las tuyaplicinas se pueden producir en cultivos de suspensión de células vegetales , [12] [13] o se pueden extraer de la madera utilizando disolventes y ultrasonicación . [14]
Las tuyaplicinas se pueden sintetizar por cicloadición de isopropil ciclopentadieno y dicloroceteno, cicloadición 1,3-dipolar de 5-isopropil-1-metil-3-oxidopiridinio, expansión de anillo de 2-isopropilciclohexanona, hidroxilación regiocontrolada de cicloaductos de oxialilo (4+3) , a partir de ( R )-(+)- limoneno regioselectivamente en varios pasos, y a partir del complejo troponeirontricarbonilo en unos pocos pasos. [15] [16] La vía de síntesis de β-tuyaplicina a partir del complejo troponeirontricarbonilo se encuentra a continuación:
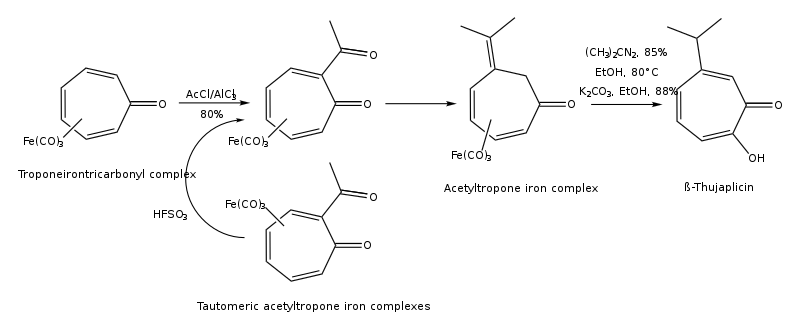
La vía de síntesis de β-tuyaplicina por alquilación electrorreductora de cicloheptatrienos sustituidos se muestra a continuación:
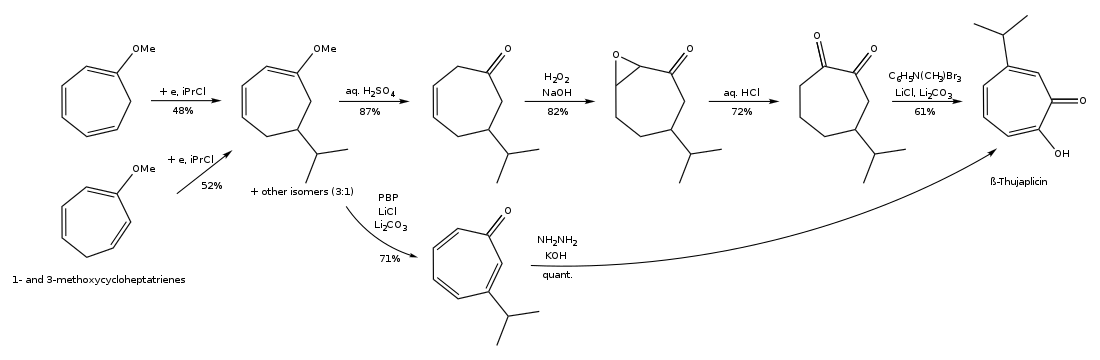
La vía de síntesis de β-tuyaplicina a través de la expansión del anillo de 2-isopropilciclohexanona se muestra a continuación:
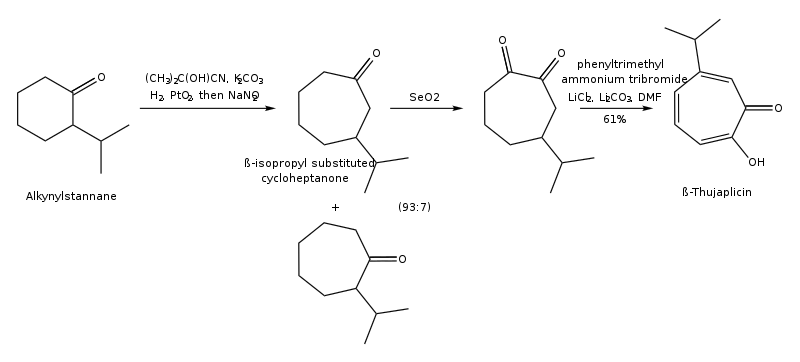
La vía de síntesis de β-tuyaplicina a través de la ciclización del catión oxialilo [4+3] (síntesis de Noyori) se muestra a continuación:

Las tuyaplicinas pertenecen a las tropolonas que contienen un anillo de carbono insaturado de siete miembros. Las tuyaplicinas son monoterpenoides que son ciclohepta-2,4,6-trien-1-ona sustituida por un grupo hidroxi en la posición 2 y un grupo isopropilo en las posiciones 3, 4 o 5. [17] Estos compuestos son enoles y cetonas cíclicas . Derivan de un hidruro de un ciclohepta-1,3,5-trieno . Las tuyaplicinas son solubles en disolventes orgánicos y tampones acuosos . El hinokitiol es soluble en etanol , dimetilsulfóxido y dimetilformamida con una solubilidad de 20, 30 y 12,5 mg/ml, respectivamente. [18] La β-tuyaplicina proporciona acetona en la oxidación vigorosa y da el diol monocíclico saturado en la hidrogenación catalítica. [19] Es estable a los álcalis y ácidos, formando sales o permaneciendo inalterado, pero no se convierte en derivados de catecol. Los complejos formados por hierro y tropolonas muestran una alta estabilidad termodinámica y han demostrado tener una constante de unión más fuerte que el complejo transferrina-hierro. [20]
Existen tres isómeros de tuyaplicina, con el grupo isopropilo posicionado progresivamente más lejos de los dos átomos de oxígeno alrededor del anillo: α-tuyaplicina, β-tuyaplicina y γ-tuyaplicina. [4] La β-tuyaplicina, también llamada hinokitiol , es la más común en la naturaleza. [21] Cada una existe en dos formas tautoméricas , intercambiando el hidrógeno hidroxilo por el otro oxígeno, lo que significa que los dos sustituyentes de oxígeno no tienen identidades distintas de "carbonilo" vs "hidroxilo". El alcance de este intercambio es que el anillo de tropolona es aromático con una naturaleza catiónica general, y la región oxígeno-hidrógeno-oxígeno tiene una naturaleza aniónica. [ cita requerida ]
Se ha demostrado que las tujaplicinas actúan contra Reticulitermes speratus (termitas japonesas), Coptotermes formosanus (supertermitas), Dermatophagoides farinae (ácaros del polvo), Tyrophagus putrescentiae (ácaros del moho), Callosobruchus chinensis (gorgojo del frijol adzuki), Lasioderma serricorne (escarabajo del cigarrillo). [9] [22] [11]
El hinokitiol también ha mostrado algunas actividades larvicidas contra Aedes aegypti (mosquito de la fiebre amarilla) y Culex pipiens (mosquito doméstico común), y actividades antiplasmodiales contra Plasmodium falciparum y Plasmodium berghei . [11]
Las tuyaplicinas, al igual que otras tropolonas, demuestran actividad quelante , actuando como ionóforo al unirse a diferentes iones metálicos. [23]
La tropolona y las tuyaplicinas exhiben una potente actividad supresora del oscurecimiento enzimático debido a la inhibición de la polifenol oxidasa y la tirosinasa . Esto se ha demostrado en experimentos con diferentes verduras, frutas, hongos, plantas y otros productos agrícolas. [11] También se ha demostrado que previenen el oscurecimiento en productos del mar . [24]
Debido a sus actividades antibacterianas contra diversos microbios que colonizan y afectan la piel, las tuyaplicinas, incluido también el tuyaplicinol , se utilizan en productos para el cuidado de la piel y el crecimiento del cabello, [25] y son especialmente populares en el este de Asia. [ cita requerida ]
El hinokitiol se utiliza en diversos productos para el cuidado bucal, incluidas pastas de dientes y aerosoles bucales. [25] [26]
Debido a su actividad antifúngica contra Malassezia pachydermatis , se utiliza en formulaciones de gotas óticas para la otitis externa en perros. [27] [28]
Considerando su actividad antifúngica contra muchos hongos fitopatógenos y sus propiedades pesticidas e insecticidas , el papel de las tuyaplicinas en la agricultura está evolucionando, incluyendo su uso en el manejo de diferentes enfermedades de las plantas y para controlar la descomposición poscosecha . [9] [29]
Las tuyaplicinas se utilizan como aditivos alimentarios en Japón. [30] Debido a su actividad supresora del pardeamiento de los alimentos y la actividad inhibidora contra las bacterias y hongos que causan el deterioro de los alimentos (como Clostridium perfringens , Alternaria alternata , Aspergillus niger , Botrytis cinerea , especies de Fusobacterium , Monilinia fructicola y Rhizopus stolonifer ), el hinokitiol también se utiliza en el envasado de alimentos como agente que prolonga la vida útil . [31] [32] [33] El tuyaplicinol , una tropolona, también se utiliza en Japón como aditivo alimentario en pequeñas cantidades.