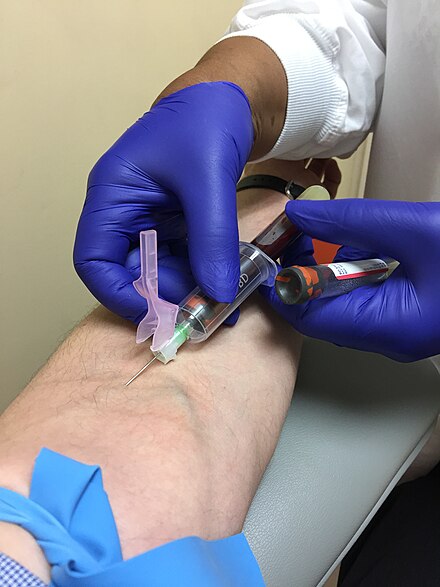
En medicina, la venopunción o venopunción es el proceso de obtención de un acceso intravenoso con el fin de tomar una muestra de sangre venosa (también llamada flebotomía ) o terapia intravenosa . En el ámbito de la atención sanitaria, este procedimiento lo realizan científicos de laboratorio médico , profesionales médicos , algunos técnicos de emergencias médicas , paramédicos , flebotomistas , técnicos de diálisis y otro personal de enfermería. [1] En medicina veterinaria , el procedimiento lo realizan médicos veterinarios y técnicos veterinarios .
Es esencial seguir un procedimiento estándar para la recolección de muestras de sangre para obtener resultados de laboratorio precisos. Cualquier error al recolectar la sangre o al llenar los tubos de ensayo puede dar lugar a resultados de laboratorio erróneos. [2]
La venopunción es uno de los procedimientos invasivos que se realizan con mayor frecuencia y se lleva a cabo por cualquiera de cinco razones:
El análisis de sangre es una importante herramienta de diagnóstico disponible para los médicos del sector sanitario.
La sangre se obtiene más comúnmente de las venas superficiales de las extremidades superiores. [1] La vena cubital mediana , que se encuentra dentro de la fosa cubital anterior al codo, está cerca de la superficie de la piel sin muchos nervios grandes ubicados cerca. Otras venas que se pueden utilizar en la fosa cubital para la punción venosa incluyen las venas cefálica , basílica y antebraquial mediana . [4]
Se pueden extraer pequeñas cantidades de sangre mediante punción digital y recolectarse de los bebés mediante un pinchazo en el talón o de las venas del cuero cabelludo con una aguja de infusión con alas .
La flebotomía (incisión en una vena) es también el tratamiento de determinadas enfermedades como la hemocromatosis y la policitemia primaria y secundaria .
Un estudio de 1996 sobre donantes de sangre (en la donación de sangre se utiliza una aguja más grande que en la punción venosa de rutina) encontró que 1 de cada 6.300 donantes sufrió una lesión nerviosa. [5]
Los riesgos y efectos secundarios pueden incluir una variedad de cosas. Mareos, sudoración y caída del ritmo cardíaco y de la presión arterial. [dieciséis ]
Hay muchas formas de extraer sangre de una vena y el método utilizado depende de la edad de la persona, el equipo disponible y el tipo de pruebas necesarias.
La mayor parte de la extracción de sangre en EE. UU., Reino Unido, Canadá y Hong Kong se realiza con un sistema de tubo de vacío. Dos sistemas comunes son Vacutainer (Becton, Dickinson y compañía) y Vacuette (Greiner Bio-One). El equipo consta de un adaptador de plástico, también conocido como tubo o portaagujas/concentrador, una aguja hipodérmica y un tubo de vacío. En determinadas circunstancias, se puede utilizar una jeringa, a menudo con una aguja de mariposa , que es un catéter de plástico unido a una aguja corta. En el mundo en desarrollo, el sistema de tubos de vacío es el método preferido para extraer sangre. [ cita necesaria ]

Greiner Bio-One fabricó el primer tubo de plástico para extracción de sangre al vacío en 1985 bajo la marca VACUETTE. Hoy en día, muchas empresas venden tubos de vacío, ya que la patente de este dispositivo es de dominio público. Estos tubos se fabrican con un volumen específico de gas extraído del tubo sellado. Cuando se inserta una aguja de un conector o dispositivo de transferencia en el tapón, el vacío del tubo aspira automáticamente el volumen de sangre requerido. [ cita necesaria ]
El sistema de tubos de vacío (ETS) básico consta de una aguja, un soporte para tubos y los tubos de vacío. El flebotomista fija la aguja al soporte del tubo antes de la recolección, o puede venir del fabricante como una sola unidad. La aguja sobresale por el extremo del portatubos y tiene una aguja en cada extremo. Después de limpiar primero el sitio de punción venosa y aplicar un torniquete, el flebotomista destapa la aguja sujeta al soporte del tubo, inserta la aguja en la vena y luego desliza los tubos evacuados en el soporte del tubo, donde el extremo posterior del tubo perfora el tapón del tubo. aguja. El vacío en el tubo extrae automáticamente la sangre necesaria directamente de la vena. Se pueden conectar y retirar varios tubos de vacío de una sola aguja, lo que permite obtener múltiples muestras de un solo procedimiento. Esto es posible gracias al manguito de muestras múltiples, que es un ajuste de goma flexible sobre el extremo posterior de la cánula de la aguja que sella la aguja hasta que se retira del camino. Esto evita que la sangre drene libremente por la parte posterior de la aguja insertada en la vena, a medida que se retira cada tubo de ensayo y se empala el siguiente. Las normas de seguridad de OSHA exigen que las agujas o los soportes para tubos vengan equipados con un dispositivo de seguridad para cubrir la aguja después del procedimiento y evitar lesiones accidentales por pinchazo. [7]
También se encuentran disponibles accesorios y adaptadores utilizados para llenar tubos de vacío de jeringas y kits de agujas de mariposa. [ cita necesaria ]
Hay varios calibres de agujas entre los que puede elegir un flebotomista. Las más utilizadas son las siguientes: una aguja de 21 g (parte superior verde), una aguja de 22 g (parte superior negra), una aguja de mariposa de 21 g (etiqueta verde), una aguja de mariposa de 23 g (etiqueta azul claro) y una aguja de mariposa de 25 g (naranja u oscuro). etiqueta azul) aguja de mariposa (sin embargo, esta aguja solo se usa en pediatría o en casos extremos, ya que es tan pequeña que a menudo puede provocar la hemolisis de la muestra de sangre). También hay una variedad de tamaños y volúmenes de tubos y botellas para diferentes requisitos de prueba. [8]
Los tubos de ensayo en los que se recoge la sangre pueden contener uno o más de varios aditivos. En general, las pruebas que requieren sangre total requieren muestras de sangre recolectadas en tubos de ensayo que contienen alguna forma de anticoagulante EDTA . El EDTA quela el calcio para prevenir la coagulación. Se prefiere el EDTA para pruebas de hematología porque causa un daño mínimo a la morfología celular. El citrato de sodio es el anticoagulante utilizado en las muestras recogidas para pruebas de coagulación. La mayoría de las pruebas químicas e inmunológicas se realizan en suero, que se produce coagulando y luego separando la muestra de sangre mediante una centrífuga. Estas muestras se recogen en un tubo sin aditivos o en uno que contiene un activador de la coagulación . Este activador de la coagulación puede interferir con algunos ensayos , por lo que en estos casos se recomienda un tubo simple, pero retrasará la prueba. Los tubos que contienen heparina de litio o heparina sódica también se usan comúnmente para una variedad de pruebas químicas, ya que no requieren coagulación y pueden centrifugarse inmediatamente después de su recolección. Para las pruebas de glucosa se utiliza una combinación de fluoruro de sodio y oxalato de potasio, ya que estos aditivos previenen la coagulación y detienen la glucolosis, de modo que los niveles de glucosa en sangre se conservan después de la recolección. [9] Otro tubo especial es un tubo opaco de color ámbar que se utiliza para recolectar sangre para analitos sensibles a la luz, como la bilirrubina . [ cita necesaria ]
Los tubos de ensayo están etiquetados con el aditivo que contienen, pero el tapón de cada tubo también está codificado por colores según el aditivo. Si bien los colores varían entre fabricantes, los colores de los tapones generalmente están asociados con cada aditivo como se detalla a continuación. Debido a que los aditivos de cada tubo se pueden dejar en la aguja utilizada para llenar los tubos, se deben extraer en un orden específico para garantizar que la contaminación cruzada no afecte negativamente las pruebas de las muestras si se extraen varios tubos a la vez. El "orden de sorteo" varía según el método de cobro. A continuación, en el orden de extracción generalmente requerido para el método de recolección del Sistema de tubos de vacío (ETS), se encuentran los tubos más comunes, enumerando el aditivo y el color: [10] [11]
El uso de iontoforesis con lidocaína es eficaz para reducir el dolor y aliviar la angustia durante la punción venosa en niños. [19] Se ha demostrado que un sistema de administración de lidocaína en polvo sin agujas disminuye el dolor de la punción venosa en niños. [20] [21] La anestesia dérmica rápida se puede lograr mediante la infiltración de anestésico local, pero puede provocar ansiedad en los niños asustados por las agujas o distorsionar la piel, lo que dificulta el acceso vascular y aumenta el riesgo de exposición a las agujas para los trabajadores de la salud. La anestesia dérmica también se puede lograr sin agujas mediante la aplicación tópica de anestésicos locales o mediante iontoforesis con lidocaína. Por el contrario, la anestesia dérmica no invasiva se puede establecer en 5 a 15 minutos sin distorsionar los tejidos subyacentes mediante iontoforesis con lidocaína, donde una corriente eléctrica directa facilita la penetración dérmica de moléculas de lidocaína cargadas positivamente cuando se colocan debajo del electrodo positivo. [ cita necesaria ]
Un estudio concluyó que la administración iontoforética de lidocaína era segura y eficaz para proporcionar anestesia dérmica para punción venosa en niños de 6 a 17 años. Es posible que esta técnica no sea aplicable a todos los niños. Los estudios futuros pueden proporcionar información sobre la dosis iontoforética mínima efectiva para la anestesia dérmica en niños y la comparación de la eficacia anestésica y la satisfacción de la iontoforesis con lidocaína con cremas anestésicas tópicas e infiltración subcutánea. [19]
Los tratamientos no farmacológicos para el dolor asociado con la punción venosa en niños incluyen hipnosis y distracción. Estos tratamientos redujeron el dolor autoinformado y, cuando se combinaron con la terapia cognitivo-conductual (TCC), la reducción del dolor fue aún mayor. No se ha encontrado que otras intervenciones sean efectivas y estas son la sugestión, soplar aire y la distracción con el asesoramiento de los padres que no difirieron del control del dolor y la angustia. [22]
Algunos trabajadores de la salud prefieren utilizar una técnica de jeringa y aguja para la punción venosa. Sarstedt fabrica un sistema de extracción de sangre (S-Monovette) que utiliza este principio. [23] Este método puede ser preferido en personas mayores, personas con cáncer, quemaduras graves, obesidad o donde las venas no son confiables o frágiles. Debido a que las jeringas se operan manualmente, la cantidad de succión aplicada se puede controlar fácilmente. Esto es particularmente útil cuando las venas son pequeñas y pueden colapsar bajo la succión de un tubo de vacío. En niños u otras circunstancias en las que la cantidad de sangre obtenida puede ser limitada, puede resultar útil saber cuánta sangre se puede obtener antes de distribuirla entre los distintos aditivos que necesitará el laboratorio. Otra alternativa es extraer sangre de cánulas permanentes. [24]
Hay ocasiones en las que se requiere una extracción de hemocultivo. El cultivo determinará si hay patógenos en la sangre. Normalmente la sangre es estéril. Al extraer sangre de cultivos, utilice una solución estéril como Betadine en lugar de alcohol . Esto se hace utilizando guantes esterilizados, sin limpiar la solución quirúrgica, tocar el sitio de punción ni comprometer de ninguna manera el proceso estéril. Es vital que el procedimiento se realice de la manera más estéril posible, ya que la presencia persistente de comensales de la piel en los hemocultivos podría indicar endocarditis , pero con mayor frecuencia se encuentran como contaminantes. Se recomienda utilizar un método abrasivo de preparación de la piel. Esto elimina las capas superiores de células muertas de la piel junto con sus bacterias contaminantes. [25] Tradicionalmente se ha utilizado povidona yodada, pero en el Reino Unido se prefiere una solución de clorhexidina al 2 % en etanol al 70 % o alcohol isopropílico y se debe dejar que se seque. Las tapas de los recipientes utilizados para extraer un hemocultivo también deben desinfectarse con una solución similar. Algunos laboratorios desaconsejan activamente el uso de yodo cuando se cree que este degrada el tapón de goma a través del cual la sangre ingresa a la botella, permitiendo así que los contaminantes ingresen al recipiente. [ cita necesaria ]
La sangre se recoge en botellas de transporte especiales, que son como tubos de vacío pero con una forma diferente. El frasco de hemocultivo contiene medios de transporte para preservar los microorganismos presentes mientras se transportan al laboratorio para los cultivos. Debido a que se desconoce si los patógenos son anaeróbicos (viven sin oxígeno) o aeróbicos (viven con oxígeno), se extrae sangre para analizar ambos. Primero se llena la botella aeróbica y luego la botella anaeróbica. Sin embargo, si la recolección se realiza con una jeringa, primero se llena la botella anaeróbica. Si se utiliza un kit de recolección de mariposas, primero se llena la botella de aeróbicos, de modo que el aire del tubo se libere a la botella que contiene oxígeno. [ cita necesaria ]
Los frascos de recolección de hemocultivos especialmente diseñados eliminan la necesidad del método de recolección con jeringa o mariposa. Estos frascos especialmente diseñados tienen cuellos largos que encajan en los soportes de los tubos de vacío que se utilizan para la recolección regular por punción venosa. Estos frascos también permiten la recolección de otras muestras de sangre a través de tubos de vacío, que se recolectarán sin punción venosa adicional. [ cita necesaria ]
La cantidad de sangre que se recolecta es crítica para la recuperación óptima de los microorganismos. Lo normal es hasta 10 ml de sangre, pero puede variar según las recomendaciones del fabricante del frasco de recolección. La recogida en lactantes y niños es de 1 a 5 ml. Si se recoge muy poca sangre, la proporción entre sangre y caldo de nutrientes inhibirá el crecimiento de microorganismos. Si se extrae demasiada sangre, existe el riesgo de anemia inducida por el hospital y la proporción entre sangre y caldo de nutrientes se inclinará en la dirección opuesta, lo que tampoco favorece un crecimiento óptimo. [ cita necesaria ]
Luego, los frascos se incuban en unidades especializadas durante 24 horas antes de que un técnico de laboratorio los estudie y/o pruebe. Este paso permite que un número muy pequeño de bacterias (potencialmente 1 o 2 organismos) se multiplique a un nivel que sea suficiente para la identificación +/-prueba de resistencia a los antibióticos. Los frascos de hemocultivo modernos tienen un indicador en la base que cambia de color en presencia de crecimiento bacteriano y puede leerse automáticamente por una máquina. (Por esta razón, las pegatinas con códigos de barras que se encuentran en estas botellas no deben quitarse, ya que las utilizan los sistemas automatizados del laboratorio ) .
Se pueden recolectar muestras de sangre de animales de laboratorio vivos utilizando los siguientes métodos: [26] [27]
El volumen de recolección de la muestra de sangre es muy importante en animales de experimentación. Toda extracción de sangre no terminal sin reposición de líquidos se limita hasta el 10 % del volumen total de sangre circulante en animales adultos sanos y normales en una sola ocasión y la extracción puede repetirse después de tres o cuatro semanas. En caso de que se requieran muestras de sangre repetidas a intervalos cortos, se puede extraer un máximo de 0,6 ml/kg/día o el 1,0% del volumen sanguíneo total de un animal cada 24 horas. El volumen sanguíneo estimado en animales adultos es de 55 a 70 ml/kg de peso corporal. Se debe tener cuidado con los animales mayores y obesos. Si el volumen de extracción de sangre excede más del 10% del volumen sanguíneo total, es posible que sea necesario reponer líquidos. Los Institutos Nacionales de Salud (NIH) recomiendan la solución de Ringer lactato (LRS) como el mejor reemplazo de líquidos. Si el volumen de sangre extraído excede más del 30% del volumen sanguíneo circulatorio total, se deben tomar las precauciones adecuadas para que el animal no desarrolle hipovolemia. [27]
Por lo general, no es aconsejable utilizar alcohol isopropílico para limpiar el sitio de punción venosa al obtener una muestra para una prueba de alcohol en sangre . Esto se ha relacionado en gran medida con las posibles implicaciones legales asociadas con el uso de limpiadores a base de alcohol que, en teoría, podrían afectar el análisis. Se han comercializado numerosos kits policiales de recolección de alcohol que incorporan un conservante de fluoruro de sodio/oxalato de potasio y agentes de limpieza sin alcohol para garantizar una recolección adecuada. En este caso, utilizar jabón y agua caliente o un hisopo con povidona yodada son alternativas recomendables al alcohol isopropílico. [ cita necesaria ]