La química covalente dinámica ( DCvC ) es una estrategia sintética empleada por los químicos para crear conjuntos moleculares y supramoleculares complejos a partir de bloques de construcción moleculares discretos. [1] La DCvC ha permitido el acceso a conjuntos complejos como estructuras orgánicas covalentes , nudos moleculares , polímeros y nuevos macrociclos . [2] La DCvC , que no debe confundirse con la química combinatoria dinámica , se ocupa únicamente de las interacciones de enlace covalente . Como tal, solo abarca un subconjunto de las químicas supramoleculares .
La idea subyacente es que el equilibrio rápido permite la coexistencia de una variedad de especies diferentes entre las cuales se pueden seleccionar moléculas con las propiedades químicas , farmacéuticas y biológicas deseadas . Por ejemplo, la adición de una plantilla adecuada cambiará el equilibrio hacia el componente que forma el complejo de mayor estabilidad ( efecto de plantilla termodinámica ). Una vez establecido el nuevo equilibrio, se modifican las condiciones de reacción para detener el equilibrio. Luego, el aglutinante óptimo para la plantilla se extrae de la mezcla de reacción mediante los procedimientos de laboratorio habituales . La propiedad de autoensamblaje y corrección de errores que permiten que el DCvC sea útil en la química supramolecular se basa en la propiedad dinámica.
Los sistemas dinámicos son conjuntos de componentes moleculares discretos que pueden ensamblarse y desensamblarse de manera reversible. Los sistemas pueden incluir múltiples especies que interactúan, lo que da lugar a reacciones competitivas.

En las mezclas de reacción dinámicas, existen múltiples productos en equilibrio. El ensamblaje reversible de componentes moleculares genera productos e intermediarios semiestables. Las reacciones pueden proceder a lo largo de vías cinéticas o termodinámicas . Las concentraciones iniciales de intermediarios cinéticos son mayores que los productos termodinámicos porque la barrera de activación más baja (ΔG‡), en comparación con la vía termodinámica, da una tasa de formación más rápida. Una vía cinética se representa en la figura 1 como un diagrama de energía violeta. Con el tiempo, los intermediarios se equilibran hacia el mínimo global, correspondiente a la energía libre de Gibbs general más baja (ΔG°), que se muestra en rojo en el diagrama de reacción de la figura 1. La fuerza impulsora para que los productos se reequilibren hacia los productos más estables se conoce como control termodinámico. La relación de productos en cualquier estado de equilibrio está determinada por las magnitudes relativas de energía libre de los productos. Esta relación entre la población y las energías relativas se denomina distribución de Maxwell-Boltzmann .
El concepto de una plantilla termodinámica se demuestra en el esquema 1. Una plantilla termodinámica es un reactivo que puede estabilizar la forma de un producto sobre otros al reducir su energía libre de Gibbs (ΔG°) en relación con otros productos. El ciclofano C2 se puede preparar mediante la reacción irreversible altamente diluida de un diol con clorobromometano en presencia de hidruro de sodio . Sin embargo, el dímero es parte de una serie de equilibrios entre macrociclos de poliacetal de diferente tamaño producidos por la transacetalización catalizada por ácido ( ácido tríflico ) . [4] Independientemente del material de partida, C2 , C4 o un producto de alta masa molar , el equilibrio eventualmente producirá una distribución del producto a través de muchos macrociclos y oligómeros. En este sistema es posible amplificar la presencia de C2 en la mezcla cuando el catalizador de transacetalización es triflato de plata porque el ion de plata encaja ideal e irreversiblemente en la cavidad C2 .

Las reacciones utilizadas en DCvC deben generar productos termodinámicamente estables para superar el costo entrópico del autoensamblaje. Las reacciones deben formar enlaces covalentes entre los bloques de construcción. Por último, todos los intermediarios posibles deben ser reversibles y la reacción se desarrolla idealmente en condiciones que sean tolerantes a los grupos funcionales en otras partes de la molécula.
Las reacciones que se pueden utilizar en DCvC son diversas y se pueden clasificar en dos categorías generales. Las reacciones de intercambio implican la sustitución de un compañero de reacción en una reacción intermolecular por otro con un tipo idéntico de enlace. Algunos ejemplos de esto se muestran en los esquemas 5 y 8, en un intercambio de éster y reacciones de intercambio de disulfuro. El segundo tipo, las reacciones de formación, se basan en la formación de nuevos enlaces covalentes. Algunos ejemplos incluyen reacciones de Diels-Alder y aldólicas . En algunos casos, una reacción puede pertenecer a ambas categorías. Por ejemplo, la formación de la base de Schiff se puede clasificar como una formación de nuevos enlaces covalentes entre un carbonilo y una amina primaria. Sin embargo, en presencia de dos aminas diferentes, la reacción se convierte en una reacción de intercambio donde los dos derivados de imina compiten en equilibrio.
Las reacciones de intercambio y formación se pueden dividir en tres categorías:
La formación de enlaces entre átomos de carbono da lugar a productos muy estables desde el punto de vista termodinámico, por lo que suelen requerir el uso de un catalizador para mejorar la cinética y garantizar la reversibilidad.
Las reacciones aldólicas se utilizan comúnmente en química orgánica para formar enlaces carbono-carbono. El motivo aldehído - alcohol común en el producto de la reacción es omnipresente en la química sintética y en los productos naturales. La reacción utiliza dos compuestos carbonílicos para generar un β- hidroxicarbonilo . La catálisis siempre es necesaria porque la barrera de activación entre los productos cinéticos y los materiales de partida hace que el proceso dinámico reversible sea demasiado lento. Los catalizadores que se han empleado con éxito incluyen la aldolasa enzimática y los sistemas basados en Al2O3 . [5]

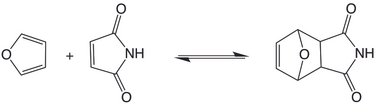
Las cicloadiciones [4+2] de un dieno y un alqueno se han utilizado como reacciones DCvC. Estas reacciones suelen ser reversibles a altas temperaturas. En el caso de los aductos de furano - maleimida , la retrocicloadición es accesible a temperaturas tan bajas como 40 °C. [6]

La metátesis de olefinas y alquinos se refiere a una reacción de formación de enlaces carbono-carbono. En el caso de la metátesis de olefinas, el enlace se forma entre dos centros de carbono con hibridación sp2. En la metátesis de alquinos, se forma entre dos centros de carbono con hibridación sp2. [ 7] La polimerización por metátesis por apertura de anillo (ROMP) se puede utilizar en la polimerización y la síntesis de macrociclos. [1]
Un motivo común de formación de enlaces covalentes dinámicos es la formación de enlaces entre un centro de carbono y un heteroátomo, como el nitrógeno o el oxígeno. Debido a que el enlace formado entre el carbono y un heteroátomo es menos estable que un enlace carbono-carbono, ofrecen más reversibilidad y alcanzan el equilibrio termodinámico más rápido que las reacciones covalentes dinámicas que forman enlaces de carbono.

El intercambio de ésteres se produce entre un éster carbonílico y un alcohol . La esterificación inversa puede tener lugar mediante hidrólisis . Este método se ha utilizado ampliamente en la síntesis de polímeros. [8]
Las reacciones de formación de enlaces entre el carbono y el nitrógeno son las más utilizadas en la química covalente dinámica. Se han utilizado más ampliamente en la química de materiales para interruptores moleculares , estructuras orgánicas covalentes y en sistemas de autoclasificación. [1]
La formación de iminas se produce entre un aldehído o una cetona y una amina primaria . De manera similar, la formación de aminales se produce entre un aldehído o una cetona y una amina secundaria vecinal. [8] Ambas reacciones se utilizan comúnmente en DCvC. [1] Si bien ambas reacciones pueden clasificarse inicialmente como reacciones de formación, en presencia de uno o más de cualquiera de los reactivos, el equilibrio dinámico entre el carbonilo y la amina se convierte en una reacción de intercambio.


La formación dinámica de enlaces heteroatómicos presenta reacciones útiles en el conjunto de herramientas de reacciones covalentes dinámicas. La condensación de ácido borónico (BAC) y el intercambio de disulfuro constituyen las dos reacciones principales en esta categoría. [1]
Los disulfuros pueden experimentar reacciones de intercambio dinámico con tioles libres . La reacción está bien documentada en el ámbito de DCvC y es una de las primeras reacciones que se ha demostrado que tiene propiedades dinámicas. [1] [9] La aplicación de la química de disulfuros tiene la ventaja adicional de ser un motivo biológico. Los residuos de cisteína pueden formar enlaces disulfuro en sistemas naturales. [1]

La autocondensación o condensación del ácido borónico con dioles es una reacción covalente dinámica bien documentada. La condensación del ácido borónico tiene la característica de formar dos enlaces dinámicos con varios sustratos. Esto es ventajoso al diseñar sistemas en los que se desea una alta rigidez, como jaulas 3-D y COF. [10]

La química covalente dinámica ha permitido el acceso a una amplia variedad de estructuras supramoleculares. Mediante las reacciones anteriores para unir fragmentos moleculares se han creado materiales de orden superior. Estos materiales incluyen macrociclos, COF y nudos moleculares. Las aplicaciones de estos productos se han utilizado en el almacenamiento de gases, la catálisis y la detección biomédica, entre otros. [1]
Recientemente se han utilizado reacciones covalentes dinámicas en la química de sistemas para iniciar cascadas de señalización mediante la liberación reversible de protones. La naturaleza dinámica de las reacciones proporciona una naturaleza de interruptor de "encendido y apagado" adecuada a los sistemas en cascada. [11]
Existen muchos ejemplos que demuestran la utilidad del DCvC en la síntesis de macrociclos. Este tipo de química es eficaz para la síntesis de macrociclos de gran tamaño porque el efecto de plantilla termodinámica es muy adecuado para estabilizar las estructuras de anillo. Además, la capacidad de corrección de errores inherente al DCvC permite que se formen estructuras de gran tamaño sin defectos. [12] [13]
Todos los métodos actuales de síntesis de estructuras orgánicas covalentes (COF) utilizan DCvC. La deshidratación con ácido borónico, como demostraron Yaghi et al., es el tipo de reacción más común utilizado. [14] Las COF se han utilizado en el almacenamiento de gases, la catálisis, . Las posibles morfologías incluyen estructuras tridimensionales covalentes infinitas, polímeros bidimensionales o jaulas moleculares discretas.
El DCvC se ha utilizado para crear moléculas con propiedades topológicas complejas. En el caso de los anillos de Borromeo , el DCvC se utiliza para sintetizar un sistema de enclavamiento de tres anillos. Las plantillas termodinámicas se utilizan para estabilizar el crecimiento del macrociclo entrelazado.