La hidrogenación asimétrica es una reacción química que añade dos átomos de hidrógeno a una molécula objetivo (sustrato) con selectividad espacial tridimensional . Fundamentalmente, esta selectividad no proviene de la molécula objetivo en sí, sino de otros reactivos o catalizadores presentes en la reacción. Esto permite que la información espacial (lo que los químicos denominan quiralidad ) se transfiera de una molécula al objetivo, formando el producto como un solo enantiómero . La información quiral está contenida más comúnmente en un catalizador y, en este caso, la información en una sola molécula de catalizador puede transferirse a muchas moléculas de sustrato, amplificando la cantidad de información quiral presente. Procesos similares ocurren en la naturaleza, donde una molécula quiral como una enzima puede catalizar la introducción de un centro quiral para dar un producto como un solo enantiómero, como aminoácidos , que una célula necesita para funcionar. Al imitar este proceso, los químicos pueden generar muchas moléculas sintéticas nuevas que interactúan con los sistemas biológicos de formas específicas, lo que conduce a nuevos agentes farmacéuticos y agroquímicos . La importancia de la hidrogenación asimétrica tanto en el ámbito académico como en la industria contribuyó a que dos de sus pioneros, William Standish Knowles y Ryōji Noyori , recibieran colectivamente la mitad del Premio Nobel de Química de 2001. [1]
En 1956 se demostró que un catalizador heterogéneo hecho de paladio depositado sobre seda producía hidrogenación asimétrica. [2] Más tarde, en 1968, los grupos de William Knowles y Leopold Horner publicaron de forma independiente los ejemplos de hidrogenación asimétrica utilizando catalizadores homogéneos . Si bien exhibieron solo excesos enantioméricos modestos , estas primeras reacciones demostraron ser factibles. En 1972, se logró un exceso enantiomérico del 90% y comenzó la primera síntesis industrial del fármaco L-DOPA contra el Parkinson utilizando esta tecnología. [3] [4]

El campo de la hidrogenación asimétrica continuó experimentando una serie de avances notables. Henri Kagan desarrolló DIOP , una difosfina C2-simétrica de fácil preparación que daba altos ee en ciertas reacciones. Ryōji Noyori introdujo los catalizadores basados en rutenio para los sustratos polares hidrogenados asimétricos, como cetonas y aldehídos. Robert H. Crabtree demostró la capacidad de los compuestos de iridio para catalizar reacciones de hidrogenación asimétrica en 1979 con la invención del catalizador de Crabtree . [5] A principios de la década de 1990, la introducción de ligandos P,N por varios grupos de forma independiente amplió aún más el alcance de los ligandos C2 - simétricos, aunque no son fundamentalmente superiores a los ligandos quirales que carecen de simetría rotacional . [6]
En la actualidad, la hidrogenación asimétrica es una metodología de rutina en la química orgánica a escala industrial y de laboratorio. La importancia de la hidrogenación asimétrica fue reconocida con el Premio Nobel de Química de 2001 otorgado a William Standish Knowles y Ryōji Noyori .
Las hidrogenaciones asimétricas funcionan mediante mecanismos convencionales utilizados para otras hidrogenaciones, entre los que se incluyen los mecanismos de esfera interna, los mecanismos de esfera externa y los mecanismos de metátesis de enlaces σ. [7] El tipo de mecanismo empleado por un catalizador depende en gran medida de los ligandos utilizados en un sistema, lo que a su vez conduce a ciertas afinidades entre el catalizador y el sustrato.
El llamado mecanismo de esfera interna implica la coordinación del alqueno con el centro metálico. [8] Otras características de este mecanismo incluyen una tendencia a la división homolítica del dihidrógeno cuando hay más metales ricos en electrones y de baja valencia, mientras que los metales pobres en electrones y de alta valencia normalmente exhiben una división heterolítica del dihidrógeno asistida por una base. [9]
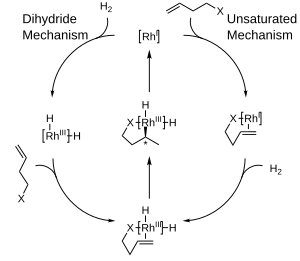
El diagrama que se muestra a continuación muestra los mecanismos propuestos para la hidrogenación catalítica con complejos de rodio , que son mecanismos de esfera interna. En el mecanismo insaturado, el producto quiral formado tendrá el modo opuesto en comparación con el catalizador utilizado. Mientras que el complejo termodinámicamente favorecido entre el catalizador y el sustrato no puede experimentar hidrogenación, el complejo inestable y desfavorecido experimenta hidrogenación rápidamente. [10] Por otro lado, el mecanismo del dihidruro ve al complejo inicialmente hidrogenado a la forma de dihidruro. Esto posteriormente permite la coordinación del doble enlace en el lado no impedido. A través de la inserción y la eliminación reductora, la quiralidad del producto coincide con la del ligando. [11]
La preferencia por producir un enantiómero en lugar de otro en estas reacciones se explica a menudo en términos de interacciones estéricas entre el ligando y el sustrato proquiral . La consideración de estas interacciones ha llevado al desarrollo de diagramas de cuadrantes donde las áreas "bloqueadas" se denotan con un recuadro sombreado, mientras que las áreas "abiertas" se dejan sin rellenar. En la reacción modelada, los grupos grandes en una olefina entrante tenderán a orientarse para llenar las áreas abiertas del diagrama, mientras que los grupos más pequeños se dirigirán a las áreas bloqueadas y luego se producirá el suministro de hidrógeno a la cara posterior de la olefina, fijando la estereoquímica . Nótese que solo se muestra una parte del ligando de fosfina quiral para mayor claridad.

Algunos catalizadores funcionan mediante "mecanismos de esfera externa", de modo que el sustrato nunca se une directamente al metal, sino que interactúa con sus ligandos, que suelen ser un hidruro metálico y un hidrógeno prótico sobre un ligando. Por ello, en la mayoría de los casos, el dihidrógeno se divide heterolíticamente, y el metal actúa como un ácido de Lewis y una base externa o interna "desprotona" el hidruro. [7]

Como ejemplo de este mecanismo podemos considerar el sistema BINAP-Ru-diamina. La forma dihaluro del catalizador se convierte en los catalizadores mediante la reacción de H 2 en presencia de una base: [12]
Los catalizadores resultantes tienen tres tipos de ligandos:
A los catalizadores de la "clase Noyori" a menudo se los denomina catalizadores bifuncionales para enfatizar el hecho de que tanto el metal como el ligando (amina) son funcionales. [13]
En la hidrogenación de sustratos que contienen C=O, durante mucho tiempo se asumió que el mecanismo operaba mediante un estado de transición pericíclico /intermedio de seis miembros mediante el cual el centro de hidruro de rutenio hidruro ( H Ru-N H ) interactúa con el sustrato carbonílico R 2 C = O . [14] Estudios DFT y experimentales más recientes han demostrado que este modelo es en gran medida incorrecto. En cambio, la cadena principal de amina interactúa fuertemente con el activador de base, que a menudo se usa en gran exceso. [12] Sin embargo, en ambos casos, el sustrato no se une directamente con el centro metálico, lo que lo convierte en un gran ejemplo de un mecanismo de esfera exterior.
Los AH prácticos emplean catalizadores basados en metal platino. [15] [16] [17]
El hierro es un objetivo de investigación popular para muchos procesos catalíticos, debido en gran medida a su bajo costo y baja toxicidad en relación con otros metales de transición. [18] Se han realizado métodos de hidrogenación asimétrica que utilizan hierro, aunque en términos de velocidades y selectividad, son inferiores a los catalizadores basados en metales preciosos. [19] En algunos casos, las nanopartículas estructuralmente mal definidas han demostrado ser las especies activas in situ y la modesta selectividad observada puede ser el resultado de sus geometrías no controladas. [20]
Los ligandos de fosfina quirales , especialmente los ligandos C2 -simétricos , son la fuente de quiralidad en la mayoría de los catalizadores de hidrogenación asimétrica. De ellos, el ligando BINAP es bien conocido, como resultado de su aplicación ganadora del Premio Nobel en la hidrogenación asimétrica de Noyori . [3]
Los ligandos de fosfina quirales pueden clasificarse generalmente como mono o bidentados . Pueden clasificarse además según la ubicación del centro estereogénico: fósforo frente a sustituyentes orgánicos. Los ligandos con un elemento de simetría C2 han sido particularmente populares, en parte porque la presencia de dicho elemento reduce drásticamente las posibles conformaciones de unión de un sustrato a un complejo metal-ligando (lo que a menudo resulta en una enantioselectividad excepcional). [21]
Los ligandos de tipo monofosfina estuvieron entre los primeros en aparecer en la hidrogenación asimétrica, por ejemplo, el ligando CAMP. [22] La investigación continua sobre estos tipos de ligandos ha explorado tanto los ligandos unidos a P -alquilo como a P -heteroátomo, con ligandos P -heteroátomo como los fosfitos y fosforamiditas logrando generalmente resultados más impresionantes. [23] Las clases estructurales de ligandos que han tenido éxito incluyen aquellos basados en la estructura binaftil de MonoPHOS [24] o el sistema de anillo espiro de SiPHOS. [25] En particular, estos ligandos monodentados se pueden usar en combinación entre sí para lograr una mejora sinérgica en la enantioselectividad; [26] algo que no es posible con los ligandos de difosfina . [23]
Los ligandos de difosfina han recibido considerablemente más atención que las monofosfinas y, tal vez como consecuencia, tienen una lista mucho más larga de logros. Esta clase incluye el primer ligando en lograr alta selectividad ( DIOP ), el primer ligando en ser utilizado en síntesis asimétrica industrial ( DIPAMP [27] [28] [4] ) y lo que probablemente sea el ligando quiral más conocido (BINAP). [3] Los ligandos de difosfina quirales ahora son omnipresentes en la hidrogenación asimétrica.

El uso de ligandos P,N en la hidrogenación asimétrica se puede rastrear hasta el ligando bisoxazolina simétrico C2 . [29] Sin embargo, estos ligandos simétricos pronto fueron reemplazados por ligandos mono oxazolina cuya falta de simetría C2 no limita de ninguna manera su eficacia en la catálisis asimétrica. [30] Dichos ligandos generalmente consisten en un heterociclo aquiral que contiene nitrógeno que está funcionalizado con un brazo colgante que contiene fósforo, aunque tanto la naturaleza exacta del heterociclo como el centro de fósforo del entorno químico han variado ampliamente. No ha surgido ninguna estructura única que sea consistentemente efectiva con una amplia gama de sustratos, aunque se han establecido ciertas estructuras privilegiadas (como la arquitectura fosfina-oxazolina o PHOX ). [31] [30] [32] Además, dentro de una clase de sustrato estrechamente definida, el rendimiento de los complejos metálicos con ligandos P,N quirales puede acercarse mucho a la conversión y selectividad perfectas en sistemas que de otro modo serían muy difíciles de apuntar. [33] Ciertos complejos derivados de ligandos quelantes de PO han mostrado resultados prometedores en la hidrogenación de cetonas y ésteres α,β-insaturados. [34]
Los ligandos simples basados en carbeno N -heterocíclico (NHC) han demostrado ser poco prácticos para la hidrogenación asimétrica.
Algunos ligandos C,N combinan un NHC con una oxazolina quiral para dar un ligando quelante. [35] [36] Los ligandos basados en NHC del primer tipo se han generado como grandes bibliotecas a partir de la reacción de bibliotecas más pequeñas de NHC y oxazolinas individuales. [35] [36] Los catalizadores basados en NHC que presentan un voluminoso metalociclo de siete miembros sobre iridio se han aplicado a la hidrogenación catalítica de olefinas no funcionalizadas [35] y alcoholes de éter vinílico con conversiones y ee en los altos 80 o 90. [37] El mismo sistema se ha aplicado a la síntesis de varios motivos aldólicos, [38] dimetil vecinales [39] y desoxipolicétidos [40] , y a los propios desoxipolicétidos. [41]
Los NHC C2 -simétricos han demostrado ser ligandos muy útiles para la hidrogenación asimétrica. [42]
Los sustratos se pueden clasificar según su polaridad. Los sustratos no polares están dominados por los alquenos . Los sustratos polares incluyen cetonas , enaminas y cetiminas .
[43]
Los alquenos que son particularmente susceptibles a la hidrogenación asimétrica a menudo presentan un grupo funcional polar adyacente al sitio que se va a hidrogenar. En ausencia de este grupo funcional, la catálisis a menudo da como resultado ee bajos. Sin embargo, para algunas olefinas no funcionalizadas, el iridio con ligandos basados en P , N ha demostrado ser eficaz. Los sustratos de alquenos a menudo se clasifican de acuerdo con sus sustituyentes, por ejemplo, olefinas 1,1-disustituidas, 1,2-diaril trisustituidas, 1,1,2-trialquil y tetrasustituidas. [44] [45] e incluso dentro de estas clases pueden existir variaciones que hagan que diferentes soluciones sean óptimas. [46]


A la inversa del caso de las olefinas, la hidrogenación asimétrica de enaminas ha favorecido a los ligandos de tipo difosfina; se han logrado excelentes resultados con sistemas basados tanto en iridio como en rodio. Sin embargo, incluso los mejores sistemas a menudo sufren de bajos ee y una falta de generalidad. Ciertas enaminas derivadas de pirrolidina de cetonas aromáticas son susceptibles de hidrogenación asimétrica con sistemas catiónicos de fosfonito de rodio (I) y sistemas de I 2 y ácido acético con valores de ee generalmente superiores al 90% y potencialmente tan altos como 99,9%. [47] Un sistema similar que utiliza iridio (I) y un ligando de fosforamidita muy estrechamente relacionado es eficaz para la hidrogenación asimétrica de enaminas de tipo pirrolidina donde el doble enlace estaba dentro del anillo: en otras palabras, de dihidropirroles. [48] En ambos casos, la enantioselectividad cayó sustancialmente cuando el tamaño del anillo se incrementó de cinco a seis.

Las cetonas y las iminas son grupos funcionales relacionados y las tecnologías eficaces para la hidrogenación asimétrica de cada uno de ellos también están estrechamente relacionadas. Los primeros ejemplos son el sistema de rutenio-difosfina-diamina quiral de Noyori. [49] [50]
En el caso de los sustratos de carbonilo e imina, la coordinación η 1 en el extremo puede competir con el modo η 2. En el caso de los sustratos unidos por η 1 , el carbono que acepta hidrógeno se elimina del catalizador y resiste la hidrogenación. [51]
Los sistemas basados en ligandos de iridio/P,N han sido eficaces para algunas cetonas e iminas. Por ejemplo, un sistema consistente para aril iminas bencílicas utiliza el ligando P,N SIPHOX junto con iridio(I) en un complejo catiónico para lograr una hidrogenación asimétrica con un ee >90%. [52] Un catalizador eficiente para cetonas ( número de recambio (TON) de hasta 4.550.000 y ee de hasta el 99,9%) es un sistema de iridio(I) con un ligando tridentado estrechamente relacionado . [53]

El catalizador BINAP/diamina-Ru es eficaz para la reducción asimétrica de cetonas funcionalizadas y simples, [54] y el catalizador BINAP/diamina-Ru puede catalizar cetonas aromáticas , heteroaromáticas y olefínicas de forma enantioselectiva. [55] Se logra una mejor estereoselectividad cuando un sustituyente es más grande que el otro (ver ángulo Flippin-Lodge ).
La hidrogenación asimétrica de sustratos aromáticos (especialmente heteroaromáticos ) es un campo muy activo de investigación en curso. Los catalizadores en este campo deben lidiar con una serie de factores que complican la situación, incluida la tendencia de los compuestos aromáticos altamente estables a resistir la hidrogenación, las capacidades potenciales de coordinación (y, por lo tanto, de envenenamiento del catalizador) tanto del sustrato como del producto, y la gran diversidad de patrones de sustitución que pueden estar presentes en cualquier anillo aromático. [56] De estos sustratos, el éxito más consistente se ha visto con heterociclos que contienen nitrógeno, donde el anillo aromático a menudo se activa ya sea por protonación o por una funcionalización adicional del nitrógeno (generalmente con un grupo protector atractor de electrones). Tales estrategias son menos aplicables a los heterociclos que contienen oxígeno y azufre, ya que ambos son menos básicos y menos nucleófilos; esta dificultad adicional puede ayudar a explicar por qué existen pocos métodos efectivos para su hidrogenación asimétrica.
Existen dos sistemas para la hidrogenación asimétrica de quinolinas 2-sustituidas con rendimientos aislados generalmente mayores del 80% y valores ee generalmente mayores del 90%. El primero es un sistema iridio(I)/fosfina quiral/I 2 , reportado por primera vez por Zhou et al . [57] Mientras que la primera fosfina quiral usada en este sistema fue MeOBiPhep, iteraciones más nuevas se han enfocado en mejorar el desempeño de este ligando. Para este fin, los sistemas usan fosfinas (o ligandos relacionados) con estabilidad al aire mejorada, [58] reciclabilidad, [58] facilidad de preparación, [59] menor carga de catalizador [60] [61] y el rol potencial de aditivos de fosfina aquiral. [62] Hasta octubre de 2012 no parece haberse propuesto ningún mecanismo, aunque se ha documentado tanto la necesidad de I 2 o un sustituto de halógeno como el posible rol del N heteroaromático en ayudar a la reactividad. [56]
El segundo es un sistema de hidrogenación por transferencia organocatalítica basado en ésteres de Hantzsch y un ácido de Brønsted quiral . En este caso, los autores prevén un mecanismo en el que la isoquinolina se protona alternativamente en un paso de activación y luego se reduce mediante la adición conjugada de hidruro del éster de Hantzsch. [63]
Gran parte de la química de hidrogenación asimétrica de las quinoxalinas está estrechamente relacionada con la de las quinolinas estructuralmente similares . Se pueden obtener resultados efectivos (y eficientes) con un sistema Ir(I)/fofinita/I 2 [64] y un sistema organocatalítico basado en ésteres de Hantzsh [65] , ambos similares a los sistemas analizados anteriormente con respecto a las quinolinas.
Las piridinas son sustratos muy variables para la reducción asimétrica (incluso en comparación con otros heteroaromáticos), ya que hay cinco centros de carbono disponibles para la sustitución diferencial en el anillo inicial. A fecha de octubre de 2012, no parece existir ningún método que pueda controlar los cinco, aunque existe al menos un método razonablemente general.
El método más general de hidrogenación asimétrica de piridina es en realidad un método heterogéneo, en el que la asimetría se genera a partir de una oxazolidinona quiral unida a la posición C2 de la piridina. La hidrogenación de dichas piridinas funcionalizadas sobre una serie de catalizadores metálicos heterogéneos diferentes dio la piperidina correspondiente con los sustituyentes en las posiciones C3, C4 y C5 en una geometría totalmente cis , con un alto rendimiento y una enantioselectividad excelente. El auxiliar de oxazolidinona también se escinde convenientemente en las condiciones de hidrogenación. [66]

Los métodos diseñados específicamente para la hidrogenación de piridinas 2-sustituidas pueden implicar sistemas asimétricos desarrollados para sustratos relacionados, como quinolinas y quinoxalinas 2-sustituidas. Por ejemplo, un sistema iridio(I)\fosfina quiral\I 2 es eficaz en la hidrogenación asimétrica de 2-piridinios activados (alquilados) [67] o ciertas piridinas fusionadas con ciclohexanona. [68] De manera similar, la catálisis ácida quiral de Brønsted con un éster de Hantzsh como fuente de hidruro es eficaz para algunas piridinas 2-alquiladas con sustitución activadora adicional. [69]
Se ha establecido la hidrogenación asimétrica de indoles con protección N -Boc . [70]

Un sistema Pd(TFA) 2 /H8-BINAP logra la cis -hidrogenación enantioselectiva de indoles 2,3- y 2-sustituidos. [71] [72]

De manera similar al comportamiento de los indoles, los pirroles pueden convertirse en pirrolidinas mediante hidrogenación asimétrica. [73]

La hidrogenación asimétrica de furanos y benzofuranos es un desafío. [74]
La hidrogenación asimétrica de tiofenos y benzotiofenos ha sido catalizada por algunos complejos de rutenio(II) de carbenos N -heterocíclicos (NHC). Este sistema parece poseer una selectividad excelente (ee > 90%) y una diastereoselectividad perfecta (todos cis ) si el sustrato tiene un anillo de fenilo fusionado (o directamente unido), pero produce solo un producto racémico en todos los demás casos evaluados. [75]

No se ha comercializado ningún catalizador heterogéneo para la hidrogenación asimétrica.
La primera hidrogenación asimétrica se centró en el paladio depositado sobre un soporte de seda. Los alcaloides de la quina se han utilizado como modificadores quirales para la hidrogenación por enantioselectividad. [76]

Una técnica alternativa que permite un mayor control sobre las propiedades estructurales y electrónicas de los sitios catalíticos activos es la inmovilización de catalizadores que se han desarrollado para la catálisis homogénea sobre un soporte heterogéneo. La unión covalente del catalizador a un polímero u otro soporte sólido es quizás la más común, aunque la inmovilización del catalizador también se puede lograr por adsorción sobre una superficie, intercambio iónico o incluso encapsulación física. Una desventaja de este enfoque es la posibilidad de que la proximidad del soporte cambie el comportamiento del catalizador, reduciendo la enantioselectividad de la reacción. Para evitar esto, el catalizador a menudo se une al soporte mediante un enlace largo, aunque se conocen casos en los que la proximidad del soporte puede realmente mejorar el rendimiento del catalizador. [76]
El enfoque final implica la construcción de MOF que incorporan sitios de reacción quirales a partir de varios componentes diferentes, que potencialmente incluyen ligandos orgánicos quirales y aquirales, iones metálicos estructurales, iones metálicos catalíticamente activos y/o núcleos organometálicos catalíticamente activos preensamblados. [77] Uno de estos involucraba catalizadores basados en rutenio . Tan solo 0,005 mol % de dichos catalizadores resultó suficiente para lograr la hidrogenación asimétrica de arilcetonas, aunque las condiciones habituales presentaban 0,1 mol % de catalizador y dieron como resultado un exceso enantiomérico de 90,6-99,2 %. [78]


Las hidrogenaciones asimétricas se utilizan en la producción de varios fármacos, como el antibacteriano levofloxina, el antibiótico carbapenémico y el agente antipsicótico BMS181100. [15] [16] [17]
La investigación de Knowles sobre la hidrogenación asimétrica y su aplicación a la síntesis a escala de producción de L-Dopa [4] le dio a la hidrogenación asimétrica un fuerte comienzo en el mundo industrial. Una revisión de 2001 indicó que la hidrogenación asimétrica representaba el 50% de la escala de producción, el 90% de la escala piloto y el 74% de los procesos catalíticos enantioselectivos a escala de laboratorio en la industria, con la salvedad de que los métodos catalíticos asimétricos en general aún no se usaban ampliamente. [79]
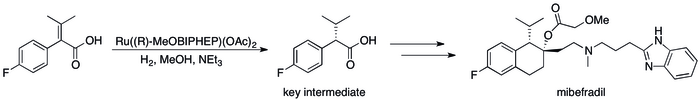
La hidrogenación asimétrica ha reemplazado a los métodos basados en resolución cinética y ha dado como resultado mejoras sustanciales en la eficiencia del proceso. [12] se puede ver en varios casos específicos donde Por ejemplo, el Grupo de Catálisis de Roche pudo lograr la síntesis de ( S , S )-Ro 67-8867 con un rendimiento general del 53%, un aumento dramático por encima del 3,5% que se logró en la síntesis basada en resolución. [80] La síntesis de mibefradil de Roche también mejoró al reemplazar la resolución con hidrogenación asimétrica, reduciendo el recuento de pasos en tres y aumentando el rendimiento de un intermedio clave al 80% del 70% original. [81]
Los catalizadores de hidrogenación inspirados en Noyori se han aplicado a la síntesis comercial de varios productos químicos finos. El (R)-1,2-propanodiol, precursor de la levofloxacina antibacteriana , se puede sintetizar de manera eficiente a partir de hidroxiacetona mediante hidrogenación asimétrica de Noyori: [17]
Las rutas más nuevas se centran en la hidrogenación del (R) -lactato de metilo . [12]
También se prepara un antibiótico carbapenémico utilizando la hidrogenación asimétrica de Noyori a través de (2S,3R)-metil 2-(benzamidometil)-3-hidroxibutanoato, que se sintetiza a partir de metil 2-(benzamidometil)-3-oxobutanoato racémico mediante resolución cinética dinámica .
Se sintetiza un agente antipsicótico BMS 181100 utilizando el catalizador BINAP/diamina-Ru.
