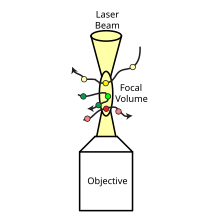
La espectroscopia de correlación cruzada de fluorescencia ( FCCS ) es una técnica espectroscópica que examina las interacciones de partículas fluorescentes de diferentes colores a medida que se difunden aleatoriamente a través de un volumen de detección microscópico a lo largo del tiempo, en condiciones estables. [1]
Eigen y Rigler introdujeron por primera vez el método de espectroscopía de correlación cruzada de fluorescencia (FCCS) en 1994. Posteriormente, en 1997, Schwille implementó experimentalmente este método. [2] [3]
FCCS es una extensión del método de espectroscopía de correlación de fluorescencia (FCS) que utiliza dos moléculas fluorescentes en lugar de una que emite colores diferentes. La técnica mide las fluctuaciones coincidentes de intensidad verde y roja de distintas moléculas que se correlacionan si las partículas marcadas en verde y rojo se mueven juntas a través de un volumen confocal predefinido. [2] FCCS utiliza dos especies que están marcadas de forma independiente con dos sondas fluorescentes diferentes de diferentes colores. Estas sondas fluorescentes son excitadas y detectadas por dos fuentes de luz láser diferentes y detectores normalmente etiquetados como "verde" y "rojo". Al combinar FCCS con un microscopio confocal , se destacan las capacidades de la técnica, ya que es posible detectar moléculas de fluorescencia en volúmenes de femtolitros dentro del rango nanomolar, con una alta relación señal-ruido y en una escala de tiempo de microsegundos. [4]
La función de correlación cruzada normalizada se define para dos especies fluorescentes, G y R, que son canales verdes y rojos independientes, respectivamente:
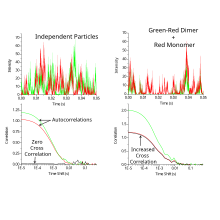
donde las señales fluorescentes diferenciales en un momento específico y en un tiempo de retardo, posteriormente se correlacionan entre sí. En ausencia de traspaso espectral (cuando la señal de fluorescencia de un canal adyacente es visible en el canal que se está observando), la función de correlación cruzada es cero para las partículas que no interactúan. A diferencia de FCS, la función de correlación cruzada aumenta a medida que aumenta el número de partículas que interactúan.
FCCS se utiliza principalmente para estudiar interacciones biomoleculares tanto en células vivas como in vitro. [5] [2] Permite medir estequiometrías moleculares simples y constantes de unión. [3] Es una de las pocas técnicas que puede proporcionar información sobre las interacciones proteína-proteína en un momento y lugar específicos dentro de una célula viva. A diferencia de la transferencia de energía por resonancia de fluorescencia , FCCS no tiene un límite de distancia para las interacciones, lo que lo hace adecuado para sondear complejos grandes. Sin embargo, FCCS requiere la difusión activa de los complejos a través del enfoque del microscopio en una escala de tiempo relativamente corta, normalmente segundos.
La función matemática utilizada para modelar curvas de correlación cruzada en FCCS es ligeramente más compleja en comparación con la utilizada en FCS. Una de las principales diferencias es el volumen de observación superpuesto efectivo, que se indica en el sentido de que los canales G y R forman un único volumen de observación:
donde y son parámetros radiales y y son los parámetros axiales para los canales G y R respectivamente.
Por lo tanto , el tiempo de difusión para una especie doblemente fluorescente (G y R) se describe de la siguiente manera:
donde es el coeficiente de difusión de la partícula doblemente fluorescente.
La curva de correlación cruzada generada a partir de la difusión de partículas fluorescentes doblemente marcadas se puede modelar en canales separados de la siguiente manera:
En el caso ideal, la función de correlación cruzada es proporcional a la concentración del complejo fluorescente doblemente marcado:
con
La amplitud de la correlación cruzada es directamente proporcional a la concentración de especies con doble etiqueta (roja y verde). [4] [6]
FCCS mide las fluctuaciones coincidentes de intensidad verde y roja de distintas moléculas que se correlacionan si las partículas marcadas en verde y rojo se mueven juntas a través de un volumen confocal predefinido. Para realizar espectroscopía de correlación cruzada de fluorescencia (FCCS), las muestras de interés primero se marcan con sondas fluorescentes de diferentes colores. La configuración FCCS normalmente incluye un microscopio confocal, dos fuentes láser y dos detectores. El microscopio confocal se utiliza para enfocar los rayos láser y recoger las señales de fluorescencia. Luego, las señales de los detectores se recopilan y registran a lo largo del tiempo. [6] [7] El análisis de datos implica la correlación cruzada de las señales para determinar el grado de correlación entre las dos sondas fluorescentes. Esta información se puede utilizar para extraer datos sobre la estequiometría y las constantes de unión de complejos moleculares, así como el momento y la ubicación de las interacciones dentro de las células vivas. [6]
La espectroscopia de correlación cruzada de fluorescencia (FCCS) tiene varias aplicaciones en el campo de la biofísica y la bioquímica . La espectroscopia de correlación cruzada de fluorescencia (FCCS) es una técnica poderosa que permite la investigación de interacciones entre varios tipos de biomoléculas , incluidas proteínas , ácidos nucleicos y lípidos . [8]
FCCS es una de las pocas técnicas que puede proporcionar información sobre las interacciones proteína-proteína en un momento y lugar específicos dentro de una célula viva. FCCS se puede utilizar para estudiar la dinámica de biomoléculas en células vivas, incluidas sus tasas de difusión y localización. [9]
Esto puede proporcionar información sobre la función y la regulación de los procesos celulares. A diferencia de la transferencia de energía por resonancia de Förster , FCCS no tiene un límite de distancia para las interacciones, lo que lo hace adecuado para sondear grandes complejos. Sin embargo, FCCS requiere la difusión activa de los complejos a través del enfoque del microscopio en una escala de tiempo relativamente corta, generalmente segundos. FCCS permite medir estequiometrías moleculares simples y constantes de unión . [9]