El experimento de coherencia cuántica única heteronuclear o correlación cuántica única heteronuclear , normalmente abreviado como HSQC , se utiliza con frecuencia en la espectroscopia de RMN de moléculas orgánicas y es de particular importancia en el campo de la RMN de proteínas . El experimento fue descrito por primera vez por Geoffrey Bodenhausen y DJ Ruben en 1980. [1] El espectro resultante es bidimensional (2D) con un eje para el protón ( 1 H) y el otro para un heteronúcleo (un núcleo atómico distinto de un protón), que normalmente es 13 C o 15 N. El espectro contiene un pico para cada protón único unido al heteronúcleo que se está considerando. El HSQC 2D también se puede combinar con otros experimentos en experimentos de RMN de dimensiones superiores, como NOESY-HSQC o TOCSY-HSQC.
El experimento HSQC es un experimento de RMN 2D de alta sensibilidad y se describió por primera vez en un sistema 1 H— 15 N, pero también es aplicable a otros núcleos como 1 H— 13 C y 1 H— 31 P. El esquema básico de este experimento implica la transferencia de magnetización del protón al segundo núcleo, que puede ser 15 N, 13 C o 31 P, a través de un paso INEPT (núcleos insensibles mejorados por transferencia de polarización). Después de un retraso de tiempo ( t 1 ), la magnetización se transfiere de nuevo al protón a través de un paso retro-INEPT y luego se registra la señal. En HSQC, se registra una serie de experimentos donde se incrementa el retraso de tiempo t 1. La señal 1 H se detecta en la dimensión medida directamente en cada experimento, mientras que el desplazamiento químico de 15 N o 13 C se registra en la dimensión indirecta que se forma a partir de la serie de experimentos.

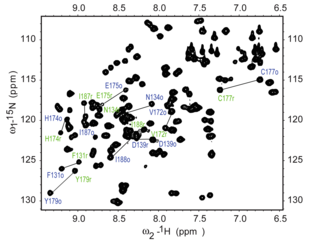
El experimento HSQC 15 N es uno de los experimentos registrados con más frecuencia en RMN de proteínas. El experimento HSQC se puede realizar utilizando la abundancia natural del isótopo 15 N , pero normalmente para la RMN de proteínas se utilizan proteínas marcadas isotópicamente. Dichas proteínas marcadas se producen generalmente expresando la proteína en células cultivadas en medios marcados con 15 N.
Cada residuo de la proteína , con excepción de la prolina , tiene un protón amida unido a un nitrógeno en el enlace peptídico . El HSQC proporciona la correlación entre el nitrógeno y el protón amida, y cada amida produce un pico en los espectros HSQC. Por lo tanto, cada residuo (excepto la prolina) puede producir un pico observable en los espectros, aunque en la práctica no siempre se ven todos los picos debido a una serie de factores. Normalmente, el residuo N-terminal (que tiene un grupo NH 3 + unido) no es fácilmente observable debido al intercambio con el disolvente. [3] Además de las resonancias de amida de la cadena principal, las cadenas laterales con protones unidos al nitrógeno también producirán picos.
En un espectro HSQC típico, los picos de NH2 de las cadenas laterales de asparagina y glutamina aparecen como dobletes en la esquina superior derecha, y puede aparecer un pico más pequeño en la parte superior de cada pico debido al intercambio de deuterio del D2O que normalmente se agrega a una muestra de RMN , lo que le da a estos picos de cadena lateral una apariencia distintiva. Los picos de amina de la cadena lateral del triptófano generalmente se desplazan hacia abajo y aparecen cerca de la esquina inferior izquierda. Los picos de amida de la cadena principal de glicina normalmente aparecen cerca de la parte superior del espectro.
El espectro HSQC 15 N es normalmente el primer espectro heteronuclear adquirido para la asignación de resonancias, en el que cada pico de amida se asigna a un residuo particular de la proteína. Si la proteína está plegada, los picos suelen estar bien dispersos y se pueden distinguir la mayoría de los picos individuales. Si hay un gran grupo de picos muy superpuestos alrededor de la mitad del espectro, eso indicaría la presencia de elementos no estructurados significativos en la proteína. En estos casos, en los que hay una superposición grave de resonancias, la asignación de resonancias en los espectros puede resultar difícil. La asignación del espectro HSQC requiere otros experimentos, idealmente utilizando experimentos de resonancia triple con proteínas marcadas con 15 N y 13 C, que proporcionan conectividades secuenciales entre residuos para que las resonancias se puedan vincular a residuos particulares y asignar secuencialmente. La asignación del espectro es esencial para una interpretación significativa de experimentos de RMN más avanzados, como la determinación de la estructura y el análisis de relajación .
Los productos químicos marcados con el isótopo 15 N son relativamente baratos, y el 15 N HSQC es un experimento sensible mediante el cual se puede adquirir un espectro en un tiempo relativamente corto, por lo que el 15 N HSQC se utiliza a menudo para examinar candidatos por su idoneidad para la determinación de la estructura por RMN, así como para optimizar las condiciones de la muestra. El proceso de determinación de la estructura, que requiere mucho tiempo, normalmente no se lleva a cabo hasta que se puede obtener un buen espectro HSQC. El experimento HSQC también es útil para detectar la interfaz de unión en la interacción proteína-proteína, así como las interacciones con ligandos como los fármacos. Al comparar el HSQC de la proteína libre con la unida al ligando, se pueden observar cambios en los desplazamientos químicos de algunos picos, y es probable que estos picos se encuentren en la superficie de unión donde la unión perturbó sus desplazamientos químicos. [4] El 15 N HSQC también se puede utilizar en el análisis de relajación en los estudios de dinámica molecular de proteínas, la determinación de la constante de ionización y otros estudios.
Este experimento proporciona correlaciones entre un carbono y sus protones unidos. La versión de tiempo constante (CT) de 1 H— 13 C HSQC se utiliza normalmente, ya que evita el problema de la división de la señal debido a los acoplamientos homonucleares 13 C— 13 C J que reducen la resolución espectral. [5] El "tiempo constante" se refiere a todo el período de evolución entre los dos pasos INEPT que se mantiene constante en este experimento. Si este período de evolución se establece como el inverso de la constante de acoplamiento J , entonces el signo de la magnetización de aquellos carbonos con un número impar de carbono alifático unido será opuesto a aquellos con un número par. Por ejemplo, si el C β de la leucina aparece como un pico positivo (2 carbonos alifáticos unidos), entonces el C γ (3 carbonos alifáticos unidos) y el C α (1 carbono alifático unido) aparecerían negativos.
El uso de 1 H— 31 P HSQC es relativamente poco común en lipidómica, sin embargo, el uso de 31 P en lipidómica se remonta a la década de 1990. [6] El uso de esta técnica es limitado con respecto a la espectrometría de masas debido a que requiere un tamaño de muestra mucho mayor, sin embargo, la combinación de 1 H— 31 P HSQC con espectrometría de masas se considera un enfoque exhaustivo para la lipidómica y las técnicas para "espectroscopia dual" se están volviendo disponibles. [7]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )