La cardiografía de impedancia (ICG) es una tecnología no invasiva que mide la conductividad eléctrica total del tórax y sus cambios en el tiempo para procesar continuamente una serie de parámetros cardiodinámicos, como el volumen sistólico (SV), la frecuencia cardíaca (FC), el gasto cardíaco (CO ), tiempo de eyección ventricular (VET), período de preeyección y se utiliza para detectar los cambios de impedancia causados por una corriente de alta frecuencia y baja magnitud que fluye a través del tórax entre dos pares adicionales de electrodos ubicados fuera del segmento medido. Los electrodos sensores también detectan la señal de ECG, que se utiliza como cronómetro del sistema. [1] [2]
La cardiografía de impedancia (ICG), también conocida como pletismografía de impedancia eléctrica (EIP) o bioimpedancia eléctrica torácica (TEB), se ha investigado desde la década de 1940. La NASA ayudó a desarrollar la tecnología en la década de 1960. [3] [4] El uso de la cardiografía de impedancia en la investigación psicofisiológica fue iniciado por la publicación de un artículo de Miller y Horvath en 1978. [5] Posteriormente, las recomendaciones de Miller y Horvath fueron confirmadas por un grupo de estándares en 1990. [ 6] Una lista completa de referencias está disponible en Publicaciones del ICG. Con ICG, la colocación de cuatro sensores duales desechables en el cuello y el pecho se utiliza para transmitir y detectar cambios eléctricos y de impedancia en el tórax, que se utilizan para medir y calcular parámetros cardiodinámicos. [ cita necesaria ]
La hemodinámica es un subcapítulo de la fisiología cardiovascular, que se ocupa de las fuerzas generadas por el corazón y el movimiento resultante de la sangre a través del sistema cardiovascular. [7] Estas fuerzas se demuestran al médico como valores pareados de flujo sanguíneo y presión arterial medidos simultáneamente en el nodo de salida del corazón izquierdo. La hemodinámica es una contraparte fluídica de la ley de Ohm en electrónica: la presión equivale al voltaje, el flujo a la corriente, la resistencia vascular a la resistencia eléctrica y el trabajo miocárdico a la potencia.

En la figura 1 se muestra la relación entre los valores instantáneos de la presión arterial aórtica y el flujo sanguíneo a través de la válvula aórtica durante un intervalo de latido y sus valores medios. Sus valores instantáneos pueden utilizarse en investigación; en la práctica clínica sus valores medios, PAM y SV, son adecuados. [ cita necesaria ]
Los parámetros del flujo sanguíneo sistémico (global) son (a) el flujo sanguíneo por latido cardíaco, el volumen sistólico, SV [ml/latido], y (b) el flujo sanguíneo por minuto, el gasto cardíaco, CO [l/min]. Existe una relación clara entre estos parámetros del flujo sanguíneo:
CO [l/min] = (SV [ml] × FC [lpm] )/1000 {Eq.1}donde FC es la frecuencia cardíaca (latidos por minuto, lpm).
Dado que el valor normal de CO es proporcional a la masa corporal que debe perfundirse, no puede existir un valor "normal" de SV y CO para todos los adultos. Todos los parámetros del flujo sanguíneo deben estar indexados. La convención aceptada es indexarlos por el Área de Superficie Corporal , BSA [m 2 ], por la Fórmula DuBois & DuBois, en función de la altura y el peso:
BSA [m 2 ] = Ancho 0,425 [kg] × Alto 0,725 [cm] × 0,007184 {Ec.2}Los parámetros indexados resultantes son el índice de carrera, SI (ml/latido/m 2 ) definido como
SI [ml/latido/m 2 ] = SV [ml] /BSA [m 2 ] {Ec.3}e índice cardíaco, IC (l/min/m 2 ), definido como
CI [l/min/m 2 ] = CO [l/min] /BSA [m 2 ] {Ec.4}Estos parámetros de flujo sanguíneo indexados exhiben rangos típicos :
Para el índice de carrera: 35 < SI típico < 65 ml/latido/m 2 ; para el índice cardíaco: 2,8 < IC típico < 4,2 l/min/m 2 .
La ecuación 1 para parámetros indexados luego cambia a
CI [l/min/m 2 ] = (SI [ml/latido/m 2 ] × FC [lpm] )/1000 {Ec.1a}La función principal del sistema cardiovascular es el transporte de oxígeno: la sangre es el vehículo, el oxígeno es la carga. La tarea del sistema cardiovascular sano es proporcionar una perfusión adecuada a todos los órganos y mantener un equilibrio dinámico entre la demanda y el suministro de oxígeno. En una persona sana, el sistema cardiovascular siempre aumenta el flujo sanguíneo en respuesta al aumento de la demanda de oxígeno. En una persona hemodinámicamente comprometida, cuando el sistema no puede satisfacer la mayor demanda de oxígeno, el flujo sanguíneo a los órganos que se encuentran en un nivel inferior en la lista de prioridades de suministro de oxígeno se reduce y estos órganos pueden, eventualmente, fallar. Los trastornos digestivos, la impotencia masculina, el cansancio, el sonambulismo y la intolerancia a la temperatura ambiental son ejemplos clásicos de un estado de bajo flujo, que resulta en un flujo sanguíneo reducido. [ cita necesaria ]
La variabilidad SI y la variabilidad MAP se logran mediante la actividad de moduladores hemodinámicos .

Los términos convencionales de fisiología cardiovascular para los moduladores hemodinámicos son precarga, contractilidad y poscarga . Se ocupan de (a) las fuerzas de llenado inerciales de la sangre que regresa a la aurícula ( precarga ), que estiran las fibras miocárdicas, almacenando así energía en ellas, (b) la fuerza mediante la cual las fibras del músculo cardíaco se acortan liberando así la energía almacenada en ellos para expulsar parte de la sangre del ventrículo hacia la vasculatura ( contractilidad ), y (c) las fuerzas que la bomba debe superar para administrar un bolo de sangre a la aorta por cada contracción ( poscarga ). Actualmente, el nivel de precarga se evalúa a partir de la PAOP (presión de oclusión de la arteria pulmonar) en un paciente cateterizado o del EDI (índice telediastólico) mediante el uso de ultrasonido. La contractilidad no se evalúa de forma rutinaria; muy a menudo se intercambian inotropía y contractilidad como términos iguales. La poscarga se evalúa a partir del valor SVRI.
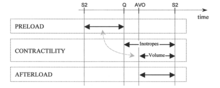
En lugar de utilizar los términos precarga, contractilidad y poscarga, la terminología y metodología preferencial en hemodinámica por latido es utilizar términos para herramientas de modulación hemodinámica reales, que el cuerpo utiliza o el médico tiene en su caja de herramientas para controlar el estado hemodinámico:
La precarga y el nivel de contractilidad inducido (mecánicamente) por Frank-Starling se modulan mediante la variación del volumen intravascular (expansión de volumen o reducción de volumen/diuresis).
La modulación farmacológica de la contractilidad se realiza con agentes inotrópicos cardioactivos (inotrópicos positivos o negativos) que están presentes en el torrente sanguíneo y afectan la velocidad de contracción de las fibras miocárdicas.
La poscarga se modula variando el calibre de los esfínteres en la entrada y salida de cada órgano, por lo tanto la resistencia vascular , con los agentes farmacológicos vasoactivos (vasoconstrictores o vasodilatadores y/o inhibidores de la ECA y/o ARA II) (ACE = convertidores de angiotensina). enzima; ARB = bloqueador del receptor de angiotensina). La poscarga también aumenta al aumentar la viscosidad de la sangre ; sin embargo, con excepción de pacientes extremadamente hemodiluidos o hemoconcentrados, este parámetro no se considera de forma rutinaria en la práctica clínica.
Con la excepción de la expansión de volumen, que sólo puede lograrse por medios físicos (ingesta de líquidos por vía intravenosa u oral), todas las demás herramientas de modulación hemodinámica son agentes farmacológicos, cardioactivos o vasoactivos.
La medición del IC y sus derivados permite a los médicos tomar decisiones oportunas sobre la evaluación, el diagnóstico, el pronóstico y el tratamiento del paciente. Está bien establecido que tanto los médicos capacitados como los no capacitados son incapaces de estimar el gasto cardíaco únicamente mediante la evaluación física.
La medición clínica del gasto cardíaco ha estado disponible desde la década de 1970. Sin embargo, esta medición del flujo sanguíneo es altamente invasiva y utiliza un catéter de termodilución dirigido por flujo (también conocido como catéter Swan-Ganz), lo que representa riesgos importantes para el paciente. Además, esta técnica es costosa (varios cientos de dólares por procedimiento) y requiere un médico capacitado y un ambiente estéril para la inserción del catéter. Como resultado, se ha utilizado sólo en estratos muy reducidos (menos del 2%) de pacientes críticos y de alto riesgo en quienes el conocimiento del flujo sanguíneo y el transporte de oxígeno superaban los riesgos del método. En los Estados Unidos, se estima que al menos dos millones de procedimientos de monitorización de catéteres de la arteria pulmonar se realizan anualmente, con mayor frecuencia en pacientes quirúrgicos cardíacos y vasculares perioperatorios, insuficiencia cardíaca descompensada, insuficiencia multiorgánica y traumatismos. [ cita necesaria ]
En teoría, una forma no invasiva de monitorear la hemodinámica proporcionaría un valor clínico excepcional porque se podrían obtener datos similares a los métodos de monitoreo hemodinámico invasivos con un costo mucho menor y sin riesgo. Si bien la monitorización hemodinámica no invasiva se puede utilizar en pacientes que previamente requirieron un procedimiento invasivo, el mayor impacto se puede lograr en pacientes y entornos de atención donde la monitorización hemodinámica invasiva no era posible ni valía el riesgo o el costo. Debido a su seguridad y bajo costo, la aplicabilidad de las mediciones hemodinámicas vitales podría extenderse a un número significativamente mayor de pacientes, incluidos los pacientes ambulatorios con enfermedades crónicas. ICG incluso se ha utilizado en condiciones extremas, como en el espacio exterior y en una expedición al Monte Everest. [8] Los pacientes con insuficiencia cardíaca, hipertensión, marcapasos y disnea son cuatro afecciones en las que la monitorización hemodinámica no invasiva ambulatoria puede desempeñar un papel importante en la evaluación, el diagnóstico, el pronóstico y el tratamiento. Algunos estudios han demostrado que el gasto cardíaco del ICG es preciso, [9] [10] mientras que otros estudios han demostrado que es inexacto. [11] Se ha demostrado que el uso de ICG mejora el control de la presión arterial en la hipertensión resistente cuando lo utilizan tanto especialistas [12] como médicos generales. [13] También se ha demostrado que la ICG predice el empeoramiento del estado de la insuficiencia cardíaca. [14]
Las señales eléctricas y de impedancia se procesan para determinar puntos fiduciales, que luego se utilizan para medir y calcular parámetros hemodinámicos, como el gasto cardíaco, el volumen sistólico, la resistencia vascular sistémica, el contenido de líquido torácico, el índice de aceleración y la relación de tiempo sistólico.