La acetil-CoA sintasa (ACS), que no debe confundirse con la acetil-CoA sintetasa o la acetato-CoA ligasa (formadora de ADP), es una enzima que contiene níquel que participa en los procesos metabólicos de las células. Junto con la monóxido de carbono deshidrogenasa (CODH), forma la enzima bifuncional acetil-CoA sintasa/monóxido de carbono deshidrogenasa (ACS/CODH) que se encuentra en microorganismos anaeróbicos como las arqueas y las bacterias . [1] La enzima ACS/CODH funciona principalmente a través de la vía de Wood-Ljungdahl que convierte el dióxido de carbono en acetil-CoA . El nombre recomendado para esta enzima es acetil-CoA sintasa CO-metilante . [2]
En la naturaleza, existen seis vías diferentes de fijación del CO2 . De ellas, la vía de Wood-Ljungdahl es el sumidero predominante en condiciones anaeróbicas. La acetil-CoA sintasa (ACS) y la deshidrogenasa de monóxido de carbono (CODH) son enzimas integrales de esta vía y, como resultado, pueden realizar diversas reacciones en el ciclo del carbono . Por ello, la actividad exacta de estas moléculas ha sido objeto de un intenso escrutinio durante la última década. [3]
La vía de Wood-Ljungdahl consta de dos reacciones diferentes que descomponen el dióxido de carbono. La primera vía implica que la CODH convierta el dióxido de carbono en monóxido de carbono mediante una transferencia de dos electrones, y la segunda reacción implica que la ACS sintetice acetil-CoA utilizando el monóxido de carbono de la CODH junto con la coenzima A (CoA) y un grupo metilo de una proteína de hierro-azufre corrinoide , CFeSP. [4] Las dos reacciones generales principales son las siguientes:
El acetil-CoA producido se puede utilizar de diversas maneras según las necesidades del organismo. Por ejemplo, las bacterias formadoras de acetato utilizan el acetil-CoA para sus procesos de crecimiento autótrofo , y las arqueas metanogénicas como Methanocarcina barkeri convierten el acetil-CoA en acetato y lo utilizan como fuente alternativa de carbono en lugar de CO 2 . [5]

Las bacterias acetogénicas utilizan este método para generar acetato y ácido acético . Dado que las dos reacciones anteriores son reversibles, se abre una amplia gama de reacciones en el ciclo del carbono. Además de la producción de acetil-CoA, puede ocurrir lo inverso, ya que la ACS produce CO y devuelve la parte de metilo a la proteína corrinoide.
Junto con el proceso de metanogénesis , los organismos pueden convertir posteriormente el acetato en metano. Además, la vía Wood-Ljungdahl permite la oxidación anaeróbica del acetato, donde se utiliza ATP para convertir el acetato en acetil-CoA, que luego es descompuesto por ACS para producir dióxido de carbono que se libera a la atmósfera. [6]
Se ha descubierto que la enzima CODH/ACS de la bacteria M. theroaceticum puede producir dinitrógeno (N 2 ) a partir de óxido nitroso en presencia de una especie donadora de electrones . También puede catalizar la reducción del contaminante 2,4,6-trinitrotolueno (TNT) y catalizar la oxidación del isocianuro de n -butilo . [3]
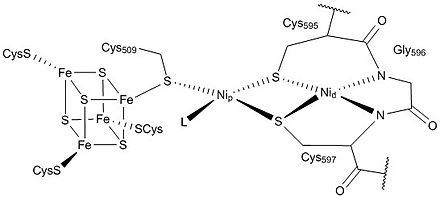
La primera y una de las estructuras cristalinas más completas de ACS/CODH de la bacteria M. thermoacetica fue presentada en 2002 por Drennan y colegas. [7] En este artículo construyeron un heterotetrámero, con el sitio activo "grupo A" ubicado en la subunidad ACS y el sitio activo "grupo C" en la subunidad CODH. Además, resolvieron la estructura del sitio activo del grupo A y encontraron un centro [Fe 4 S 4 ]-X-Cu-X-Ni que es altamente inusual en biología. Esta representación estructural consistía en una unidad [Fe 4 S 4 ] unida a un centro binuclear, donde Ni(II) residía en la posición distal (denotada como Ni d ) en una conformación plano-cuadrada y un ion Cu(I) residía en la posición proximal en una posición tetraédrica distorsionada con ligandos de identidad desconocida. [7]
El debate sobre la estructura absoluta y la identidad de los metales en el sitio activo del grupo A de ACS continuó, con la presentación de un modelo competidor. Los autores sugirieron dos formas diferentes de la enzima ACS, una forma "abierta" y una forma "cerrada", con diferentes metales ocupando el sitio metálico proximal (denotado como M p ) para cada forma. El esquema general de la enzima siguió de cerca los hallazgos del primer estudio, pero esta nueva estructura propuso un ion de níquel en la forma "abierta" y un ion de zinc en la forma "cerrada". [4]
Un artículo de revisión posterior intentó conciliar las diferentes observaciones de M p y afirmó que esta posición proximal en el sitio activo de ACS era propensa a la sustitución y podía contener cualquiera de Cu , Zn y Ni . Las tres formas de este grupo A probablemente contienen una pequeña cantidad de Ni y una cantidad relativamente mayor de Cu. [8]

En la actualidad, se acepta generalmente que el sitio activo de ACS (grupo A) es un centro metálico Ni-Ni con ambos níqueles con un estado de oxidación +2. El grupo [Fe 4 S 4 ] está unido al níquel más cercano, N p , que está conectado a través de un puente tiolato al níquel más lejano, Ni d . El Ni d está coordinado con dos moléculas de cisteína y dos compuestos de amida de la cadena principal, y está en una coordinación cuadrado-planar . El espacio junto al metal puede acomodar sustratos y productos. El Ni p está en un entorno en forma de T unido a tres átomos de azufre, con un ligando desconocido que posiblemente crea un entorno tetraédrico distorsionado . Se ha planteado la hipótesis de que este ligando es una molécula de agua o un grupo acetilo en el área circundante de la célula. Aunque el níquel proximal es lábil y puede reemplazarse con un centro de Cu o Zn, la evidencia experimental sugiere que la actividad de ACS está limitada a la presencia de níquel únicamente. Además, algunos estudios han demostrado que el cobre puede incluso inhibir la enzima en determinadas condiciones. [9]
La estructura general de la enzima CODH/ACS consiste en la enzima CODH como un dímero en el centro con dos subunidades ACS en cada lado. El núcleo de CODH está formado por dos grupos Ni-Fe-S (grupo C), dos grupos [Fe 4 S 4 ] (grupo B) y un grupo D [Fe 4 S 4 ]. El grupo D une las dos subunidades con un grupo C y uno B en cada monómero, lo que permite una rápida transferencia de electrones . El grupo A de ACS está en constante comunicación con el grupo C en CODH. Este sitio activo también es responsable de las formaciones de enlaces CC y CS en el producto acetil-CoA (y su reacción inversa). [8]
Además, se han resuelto las estructuras cristalinas del complejo CODH/ACS de Carboxydothermushydrogenoformans [10] y Clostridium autoethanogenum [11] . Mientras que este último muestra una disposición más extendida de las subunidades ACS, el complejo de C.hydrogenoformans es muy similar al de M. thermoacetica .
La enzima ACS contiene tres subunidades principales. La primera es el sitio activo propiamente dicho con el centro NiFeS. La segunda es la parte que interactúa directamente con CODH en la vía Wood-Ljungdahl. Esta parte está formada por α-hélices que entran en un pliegue de Rossmann . También parece interactuar con un compuesto ferredoxina que puede activar la subunidad durante el proceso de transferencia de CO desde CODH a ACS. El dominio final se une a CoA y consta de seis residuos de arginina con una molécula de triptófano . [3] [12]
Los experimentos entre el grupo C de CODH y el grupo A de ACS revelan un canal hidrofóbico largo que conecta los dos dominios para permitir la transferencia de monóxido de carbono de CODH a ACS. Es muy probable que este canal proteja las moléculas de monóxido de carbono del entorno externo de la enzima y aumente la eficiencia de la producción de acetil-CoA. [13]
Estudios en la literatura han podido aislar la enzima CODH/ACS en una configuración "abierta" y "cerrada". Esto ha llevado a la hipótesis de que sufre cuatro cambios conformacionales dependiendo de su actividad. Con la posición "abierta", el sitio activo gira para interactuar con la proteína CFeSP en el paso de transferencia de metilo de la vía Wood-Ljungdahl . La posición "cerrada" abre el canal entre CODH y ACS para permitir la transferencia de CO. Estas dos configuraciones son opuestas entre sí en el sentido de que el acceso al CO bloquea la interacción con CFeSP, y cuando se produce la metilación, el sitio activo queda enterrado y no permite la transferencia de CO. Se necesita una segunda posición "cerrada" para bloquear el agua de la reacción. Finalmente, el grupo A debe girarse una vez más para permitir la unión de CoA y la liberación del producto. El desencadenante exacto de estos cambios estructurales y los detalles mecanísticos aún están por resolver. [3] [6] [9]

Se han propuesto dos mecanismos en competencia para la formación de acetil-CoA, el " mecanismo paramagnético " y el " mecanismo diamagnético ". [3] Ambos son similares en términos de la unión de sustratos y los pasos generales, pero difieren en el estado de oxidación del centro metálico. Se cree que el Ni p es el centro de unión del sustrato que experimenta redox . No se cree que el centro de níquel más alejado y el grupo [Fe 4 S 4 ] estén involucrados en el proceso. [13]
En el mecanismo paramagnético , algún tipo de complejo ( ferrodoxina , por ejemplo) activa el átomo de Ni p , reduciéndolo de Ni 2+ a Ni 1+ . Luego, el níquel se une al monóxido de carbono de CODH o al grupo metilo donado por la proteína CFeSP sin ningún orden en particular. [14] A esto le sigue una inserción migratoria para formar un complejo intermedio. Luego, el CoA se une al metal y se forma el producto final, acetil-CoA. [3] [9] Algunas críticas a este mecanismo son que está desequilibrado en términos de recuento de electrones y que el intermedio Ni 1+ activado no se puede detectar con resonancia paramagnética electrónica . Además, hay evidencia del ciclo catalítico ACS sin ningún complejo reductor externo, lo que refuta el paso de activación de la ferrodoxina . [15]
El segundo mecanismo propuesto, el mecanismo diamagnético, implica un intermedio Ni 0 en lugar de un Ni 1+ . Después de la adición del grupo metilo y el monóxido de carbono, seguida de la inserción para producir el complejo metal-acetilo, el CoA ataca para producir el producto final. [9] El orden en el que la molécula de monóxido de carbono y el grupo metilo se unen al centro de níquel ha sido muy debatido, pero ninguna evidencia sólida ha demostrado preferencia por uno sobre el otro. Aunque este mecanismo está equilibrado electrónicamente, la idea de una especie de Ni 0 no tiene precedentes en biología. Tampoco ha habido evidencia sólida que respalde la presencia de una especie de Ni de valencia cero . Sin embargo, se han creado especies de níquel similares al ACS con un centro de Ni 0 , por lo que el mecanismo diamagnético no es una hipótesis inverosímil. [1]