La N -acetiltransferasa ( NAT ) es una enzima que cataliza la transferencia de grupos acetilo desde acetil-CoA a arilaminas , arilhidroxilaminas y arilhidrazinas. [1] [2] [3] Tienen una amplia especificidad para las aminas aromáticas , particularmente la serotonina , y también pueden catalizar la transferencia de acetilo entre arilaminas sin CoA. Las N -acetiltransferasas son enzimas citosólicas que se encuentran en el hígado y muchos tejidos de la mayoría de las especies de mamíferos, excepto el perro y el zorro , que no pueden acetilar xenobióticos . [4] Los grupos acetilo son importantes en la conjugación de metabolitos del hígado, para permitir la excreción de los subproductos ( metabolismo de fase II ). Esto es especialmente importante en el metabolismo y la excreción de productos farmacológicos ( metabolismo de fármacos ).
Las enzimas NAT se diferencian por la presencia de una tríada catalítica conservada que favorece los sustratos de amina aromática e hidrazina . [5] [6] Las NAT catalizan la acetilación de moléculas pequeñas a través de una reacción de doble desplazamiento llamada reacción ping pong bi bi. [5] El mecanismo consta de dos reacciones secuenciales. [5] En la reacción uno, el acetil-CoA se une inicialmente a la enzima y acetila Cys 68. [5] En la reacción dos, después de que se libera el acetil-CoA , el aceptor de acetilo interactúa con la enzima acetilada para formar el producto. [5] Esta segunda reacción es independiente del donante de acetilo ya que abandona la enzima antes de que se una el aceptor de acetilo. [5] Sin embargo, como con muchas reacciones ping pong bi bi, es posible que haya competencia entre el donante de acetilo y el aceptor de acetilo por la enzima no acetilada. [5] Esto conduce a una inhibición dependiente del sustrato a altas concentraciones. [5]

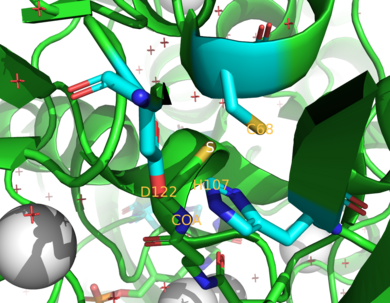
Las dos enzimas NAT en humanos son NAT1 y NAT2 . [4] Los ratones y ratas expresan tres enzimas, NAT1, NAT2 y NAT3. [4] Se ha descubierto que NAT1 y NAT2 están estrechamente relacionadas en las especies examinadas hasta ahora, ya que las dos enzimas comparten el 75-95% de su secuencia de aminoácidos . [9] [10] Ambas también tienen un residuo de cisteína del sitio activo (Cys 68 ) en la región N-terminal. [9] [10] Además, todas las enzimas NAT funcionales contienen una tríada de residuos catalíticamente esenciales compuestos por esta cisteína , histidina y asparagina . [7] Se ha planteado la hipótesis de que los efectos catalíticos del fármaco contra el cáncer de mama cisplatino están relacionados con Cys 68. [11] La inactivación de NAT1 por cisplatino es causada por una formación irreversible de un aducto de cisplatino con el residuo de cisteína del sitio activo . [11] El extremo C ayuda a unir acetil CoA y difiere entre los NAT, incluidos los homólogos procariotas. [12]
NAT1 y NAT2 tienen especificidades de sustrato diferentes pero superpuestas. [4] NAT1 humano acetila preferentemente ácido 4-aminobenzoico (PABA), ácido 4 aminosalicílico , sulfametoxazol y sulfanilamida . [4] NAT2 humano acetila preferentemente isoniazida (tratamiento para la tuberculosis ), hidralazina , procainamida , dapsona , aminoglutetimida y sulfametazina . [4]
NAT2 está involucrado en el metabolismo de xenobióticos , lo que puede conducir tanto a la inactivación de fármacos como a la formación de metabolitos tóxicos que pueden ser cancerígenos . [13] La biotransformación de xenobióticos puede ocurrir en tres fases. [13] En la fase I, se introducen grupos reactivos y polares en los sustratos. En la fase II, se produce la conjugación de xenobióticos con especies cargadas, y en la fase III se realizan modificaciones adicionales, con mecanismos de eflujo que conducen a la excreción por transportadores. [13] Un estudio de asociación de todo el genoma (GWAS) identificó a NAT2 humano como la principal señal de resistencia a la insulina , un marcador clave de diabetes y un importante factor de riesgo cardiovascular [13] y se ha demostrado que está asociado con la resistencia a la insulina de todo el cuerpo en ratones knock out de NAT1 . [14] Se cree que NAT1 tiene un papel endógeno , probablemente vinculado al metabolismo celular fundamental. [13] Esto puede estar relacionado con el motivo por el que NAT1 se distribuye más ampliamente entre los tejidos que NAT2. [13]
Cada individuo metaboliza xenobióticos a diferentes velocidades, como resultado de polimorfismos de los genes del metabolismo de xenobióticos . [13] Tanto NAT1 como NAT2 están codificados por dos genes altamente polimórficos ubicados en el cromosoma 8. [ 4] Los polimorfismos de NAT2 fueron una de las primeras variaciones para explicar esta variabilidad interindividual para el metabolismo de fármacos . [15] Estos polimorfismos modifican la estabilidad y/o la actividad catalítica de las enzimas que alteran las tasas de acetilación de fármacos y xenobióticos, un rasgo llamado fenotipo acetilador . [16] Para NAT2, el fenotipo acetilador se describe como lento, intermedio o rápido. [17] Más allá de modificar la actividad enzimática, los estudios epidemiológicos han encontrado una asociación de polimorfismos de NAT2 con varios cánceres, probablemente a partir de diversos carcinógenos ambientales . [13]
De hecho, NAT2 es altamente polimórfico en varias poblaciones humanas. [18] Los polimorfismos de NAT2 incluyen las sustituciones de un solo aminoácido R64Q, I114T, D122N, L137F, Q145P, R197Q y G286E. [18] Estos se clasifican como acetiladores lentos, mientras que el NAT2 de tipo salvaje se clasifica como un acetilador rápido. [18] Los acetiladores lentos tienden a estar asociados con la toxicidad de los fármacos y la susceptibilidad al cáncer. [18] Por ejemplo, el genotipo acetilador lento NAT2 está asociado con un mayor riesgo de cáncer de vejiga , especialmente entre los fumadores de cigarrillos. [19] Los polimorfismos de un solo nucleótido (SNP) de NAT1 incluyen R64W, V149I, R187Q, M205V, S214A, D251V, E26K e I263V, y están relacionados con la predisposición genética al cáncer , defectos de nacimiento y otras enfermedades. [20] El efecto de los SNP acetiladores lentos en la región codificante actúa predominantemente a través de la creación de una proteína inestable que se agrega intracelularmente antes de la ubiquitinación y degradación. [3]
El 50% de la población británica tiene deficiencia de N -acetiltransferasa hepática. Esto se conoce como estado acetilador negativo. Los medicamentos afectados por esto son:
Los eventos adversos de esta deficiencia incluyen neuropatía periférica y hepatoxicidad . [21] El haplotipo acetilador más lento , NAT2*5B (la asociación más fuerte con el cáncer de vejiga ), parece haber sido seleccionado en los últimos 6.500 años en personas de Eurasia occidental y central, lo que sugiere que la acetilación lenta dio una ventaja evolutiva a esta población, a pesar de los datos recientes desfavorables de resultados de salud epidemiológicos. [22]
La siguiente es una lista de genes humanos que codifican enzimas N-acetiltransferasas: