
La serie de Balmer , o líneas de Balmer en física atómica , es una de un conjunto de seis series nombradas que describen las emisiones de líneas espectrales del átomo de hidrógeno . La serie de Balmer se calcula utilizando la fórmula de Balmer, una ecuación empírica descubierta por Johann Balmer en 1885.
El espectro visible de la luz del hidrógeno muestra cuatro longitudes de onda , 410 nm , 434 nm, 486 nm y 656 nm, que corresponden a emisiones de fotones por electrones en estados excitados que pasan al nivel cuántico descrito por el número cuántico principal n igual a 2. [1] Hay varias líneas ultravioleta de Balmer prominentes con longitudes de onda inferiores a 400 nm. La serie continúa con un número infinito de líneas cuyas longitudes de onda se acercan asintóticamente al límite de 364,5 nm en el ultravioleta.
Después del descubrimiento de Balmer, se descubrieron otras cinco series espectrales de hidrógeno , correspondientes a electrones en transición a valores de n distintos de dos.
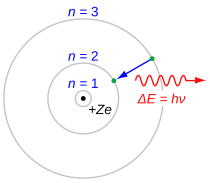
La serie de Balmer se caracteriza por la transición del electrón de n ≥ 3 a n = 2, donde n se refiere al número cuántico radial o número cuántico principal del electrón. Las transiciones se nombran secuencialmente mediante letras griegas: n = 3 an = 2 se llama H-α, 4 a 2 es H-β, 5 a 2 es H-γ y 6 a 2 es H-δ. Como las primeras líneas espectrales asociadas a esta serie se ubican en la parte visible del espectro electromagnético , estas líneas se denominan históricamente "H-alfa", "H-beta", "H-gamma", etc., donde H es el elemento hidrógeno.
Aunque los físicos conocían las emisiones atómicas antes de 1885, carecían de una herramienta para predecir con precisión dónde deberían aparecer las líneas espectrales. La ecuación de Balmer predice las cuatro líneas espectrales visibles del hidrógeno con gran precisión. La ecuación de Balmer inspiró la ecuación de Rydberg como una generalización de la misma, y esto a su vez llevó a los físicos a encontrar las series de Lyman , Paschen y Brackett , que predijeron otras líneas espectrales del hidrógeno que se encuentran fuera del espectro visible .
La línea espectral roja H-alfa de la serie Balmer del hidrógeno atómico, que es la transición de la capa n = 3 a la capa n = 2, es uno de los colores más llamativos del universo . Aporta una línea roja brillante a los espectros de emisión o nebulosa de ionización, como la Nebulosa de Orión , que a menudo son regiones H II que se encuentran en regiones de formación de estrellas. En imágenes en color real, estas nebulosas tienen un color rosa rojizo debido a la combinación de líneas de Balmer visibles que emite el hidrógeno.
Más tarde, se descubrió que cuando las líneas de la serie de Balmer del espectro del hidrógeno se examinaban a muy alta resolución, eran dobletes muy próximos entre sí. Esta división se llama estructura fina . También se descubrió que los electrones excitados de capas con n mayor que 6 podían saltar a la capa n = 2, emitiendo tonos de ultravioleta al hacerlo.

Balmer notó que una sola longitud de onda tenía relación con cada línea del espectro del hidrógeno que se encontraba en la región de la luz visible . Esa longitud de onda era364,506 82 nm . Cuando cualquier número entero mayor que 2 se eleva al cuadrado y luego se divide por sí mismo al cuadrado menos 4, entonces ese número se multiplica por364,506 82 nm (ver ecuación a continuación) dio la longitud de onda de otra línea en el espectro del hidrógeno. Con esta fórmula, pudo demostrar que algunas mediciones de líneas realizadas en su época mediante espectroscopia eran ligeramente inexactas, y su fórmula también predijo líneas que aún no se habían observado pero que se encontraron más tarde. Su número también resultó ser el límite de la serie. La ecuación de Balmer podría usarse para encontrar la longitud de onda de las líneas de absorción/emisión y se presentó originalmente de la siguiente manera (salvo por un cambio de notación para dar la constante de Balmer como B ):
Dónde
En 1888, el físico Johannes Rydberg generalizó la ecuación de Balmer para todas las transiciones del hidrógeno. La ecuación comúnmente utilizada para calcular la serie de Balmer es un ejemplo específico de la fórmula de Rydberg y sigue como una simple reordenación matemática recíproca de la fórmula anterior (convencionalmente usando una notación de m para n como única constante integral necesaria):
donde λ es la longitud de onda de la luz absorbida/emitida y RH es la constante de Rydberg para el hidrógeno. Se considera que la constante de Rydberg es igual a4/Ben la fórmula de Balmer, y este valor, para un núcleo infinitamente pesado, es4/3,645 0682 × 10 −7m =10 973 731 , 57 m −1 . [3]
La serie de Balmer es particularmente útil en astronomía porque las líneas de Balmer aparecen en numerosos objetos estelares debido a la abundancia de hidrógeno en el universo y, por lo tanto, se ven comúnmente y son relativamente fuertes en comparación con las líneas de otros elementos.
La clasificación espectral de las estrellas, que consiste principalmente en la determinación de la temperatura de la superficie, se basa en la fuerza relativa de las líneas espectrales, y la serie de Balmer en particular es muy importante. Otras características de una estrella que pueden determinarse mediante un análisis detallado de su espectro incluyen la gravedad superficial (relacionada con el tamaño físico) y la composición.
Debido a que las líneas de Balmer se ven comúnmente en los espectros de varios objetos, a menudo se usan para determinar velocidades radiales debido al desplazamiento Doppler de las líneas de Balmer. Esto tiene usos importantes en toda la astronomía, desde detectar estrellas binarias , exoplanetas , objetos compactos como estrellas de neutrones y agujeros negros (mediante el movimiento del hidrógeno en discos de acreción a su alrededor), identificar grupos de objetos con movimientos similares y presumiblemente orígenes ( grupos en movimiento) . , cúmulos de estrellas , cúmulos de galaxias y restos de colisiones), determinar distancias (en realidad corrimientos al rojo ) de galaxias o quásares e identificar objetos desconocidos mediante el análisis de su espectro.
Las líneas de Balmer pueden aparecer como líneas de absorción o emisión en un espectro, dependiendo de la naturaleza del objeto observado. En las estrellas , las líneas de Balmer suelen verse en absorción y son "más fuertes" en estrellas con una temperatura superficial de aproximadamente 10.000 kelvin ( tipo espectral A). En los espectros de la mayoría de las galaxias espirales e irregulares, núcleos galácticos activos , regiones H II y nebulosas planetarias , las líneas de Balmer son líneas de emisión.
En los espectros estelares, la línea H-épsilon (transición 7→2, 397,007 nm) a menudo se mezcla con otra línea de absorción causada por calcio ionizado conocida como "H" (la designación original dada por Joseph von Fraunhofer ). H-épsilon está separado por 0,16 nm de Ca II H a 396,847 nm y no se puede resolver en espectros de baja resolución. La línea H-zeta (transición 8→2) se mezcla de manera similar con una línea neutra de helio que se ve en las estrellas calientes.