
En biología química , la tonicidad es una medida del gradiente de presión osmótica efectiva ; el potencial hídrico de dos soluciones separadas por una membrana celular parcialmente permeable . La tonicidad depende de la concentración relativa de solutos selectivos impermeables a la membrana a través de una membrana celular que determina la dirección y el alcance del flujo osmótico . Se utiliza comúnmente para describir la respuesta de hinchazón versus contracción de las células sumergidas en una solución externa.
A diferencia de la presión osmótica, la tonicidad se ve influida únicamente por los solutos que no pueden atravesar la membrana, ya que sólo estos ejercen una presión osmótica efectiva. Los solutos capaces de atravesar libremente la membrana no afectan la tonicidad porque siempre se equilibrarán con concentraciones iguales en ambos lados de la membrana sin movimiento neto del disolvente. También es un factor que afecta a la imbibición .
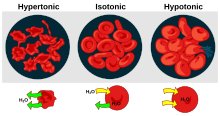
Hay tres clasificaciones de tonicidad que puede tener una solución en relación con otra: hipertónica , hipotónica e isotónica . [1] Un ejemplo de solución hipotónica es el agua destilada.

Una solución hipertónica tiene una mayor concentración de solutos no permeables que otra solución. [2] En biología, la tonicidad de una solución generalmente se refiere a su concentración de solutos en relación con la de otra solución en el lado opuesto de una membrana celular ; una solución fuera de una célula se llama hipertónica si tiene una mayor concentración de solutos que el citosol dentro de la célula. Cuando una célula se sumerge en una solución hipertónica, la presión osmótica tiende a forzar al agua a fluir fuera de la célula para equilibrar las concentraciones de los solutos en ambos lados de la membrana celular. El citosol se clasifica inversamente como hipotónico, opuesto a la solución exterior. [3] [4]
Cuando las células vegetales se encuentran en una solución hipertónica, la membrana celular flexible se separa de la pared celular rígida , pero permanece unida a la pared celular en puntos llamados plasmodesmos . Las células a menudo adquieren la apariencia de un alfiletero , y los plasmodesmos casi dejan de funcionar porque se contraen, una condición conocida como plasmólisis . En las células vegetales, los términos isotónico, hipotónico e hipertónico no se pueden usar con precisión estricta porque la presión ejercida por la pared celular afecta significativamente el punto de equilibrio osmótico. [5]
Algunos organismos han desarrollado métodos intrincados para evitar la hipertonía. Por ejemplo, el agua salada es hipertónica para los peces que viven en ella. Debido a que los peces necesitan una gran superficie en sus branquias en contacto con el agua de mar para el intercambio de gases , pierden agua osmóticamente al mar desde las células branquiales. Responden a la pérdida bebiendo grandes cantidades de agua salada y excretando activamente el exceso de sal. [6] Este proceso se llama osmorregulación . [7]
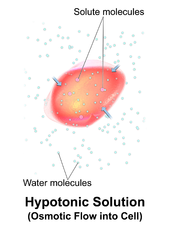
Una solución hipotónica tiene una concentración de solutos menor que otra solución. En biología, una solución fuera de una célula se llama hipotónica si tiene una concentración de solutos menor en relación con el citosol . Debido a la presión osmótica , el agua se difunde en la célula y la célula a menudo parece turgente o hinchada. Para las células sin pared celular , como las células animales, si el gradiente es lo suficientemente grande, la absorción de exceso de agua puede producir suficiente presión para inducir la citólisis o ruptura de la célula. Cuando las células vegetales están en una solución hipotónica, la vacuola central absorbe agua adicional y empuja la membrana celular contra la pared celular. Debido a la rigidez de la pared celular, empuja hacia atrás, evitando que la célula explote. Esto se llama presión de turgencia . [8]
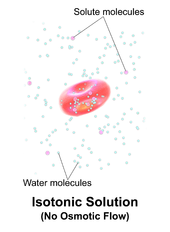
Una solución es isotónica cuando su concentración efectiva de osmoles es la misma que la de otra solución. En biología, las soluciones a ambos lados de una membrana celular son isotónicas si la concentración de solutos fuera de la célula es igual a la concentración de solutos dentro de la célula. En este caso, la célula no se hincha ni se encoge porque no hay un gradiente de concentración que induzca la difusión de grandes cantidades de agua a través de la membrana celular. Las moléculas de agua se difunden libremente a través de la membrana plasmática en ambas direcciones y, como la velocidad de difusión del agua es la misma en cada dirección, la célula no ganará ni perderá agua.
Una solución isoosmolar puede ser hipotónica si el soluto es capaz de penetrar la membrana celular. Por ejemplo, una solución de urea isoosmolar es hipotónica para los glóbulos rojos, lo que provoca su lisis . Esto se debe a que la urea entra en la célula a favor de su gradiente de concentración, seguida por el agua. La osmolaridad de la solución salina normal , 9 gramos de NaCl disueltos en agua para un volumen total de un litro, es una aproximación cercana a la osmolaridad del NaCl en la sangre (aproximadamente 290 mOsm / L ). Por lo tanto, la solución salina normal es casi isotónica para el plasma sanguíneo. Ni los iones de sodio ni de cloruro pueden pasar libremente a través de la membrana plasmática, a diferencia de la urea .