En química organometálica , el principio isolobal (más formalmente conocido como analogía isolobal ) es una estrategia utilizada para relacionar la estructura de fragmentos moleculares orgánicos e inorgánicos con el fin de predecir las propiedades de enlace de compuestos organometálicos. [1] Roald Hoffmann describió los fragmentos moleculares como isolobales "si el número, las propiedades de simetría , la energía aproximada y la forma de los orbitales fronterizos y el número de electrones en ellos son similares, no idénticos, sino similares". [2] Se puede predecir el enlace y la reactividad de una especie menos conocida a partir de la de una especie más conocida si los dos fragmentos moleculares tienen orbitales fronterizos similares, el orbital molecular ocupado más alto (HOMO) y el orbital molecular desocupado más bajo (LUMO). ). Los compuestos isolobales son análogos de los compuestos isoelectrónicos que comparten el mismo número de electrones de valencia y estructura. En la Figura 1 se encuentra una representación gráfica de estructuras isolobales, con los pares isolobales conectados a través de una flecha de doble punta con medio orbital debajo.
Por su trabajo sobre la analogía isolobal, Hoffmann recibió el Premio Nobel de Química en 1981, que compartió con Kenichi Fukui . [3] En su conferencia del Premio Nobel, Hoffmann enfatizó que la analogía isolobal es un modelo útil, pero simple, y por lo tanto está destinada a fallar en ciertos casos. [1]
Para comenzar a generar un fragmento isolobal, la molécula necesita seguir ciertos criterios. [4] Las moléculas basadas en elementos del grupo principal deben satisfacer la regla del octeto cuando todos los orbitales moleculares (MO) enlazantes y no enlazantes están llenos y todos los MO antienlazantes están vacíos. Por ejemplo, el metano es una molécula simple a partir de la cual se puede formar un fragmento del grupo principal. La eliminación de un átomo de hidrógeno del metano genera un radical metilo. La molécula conserva su geometría molecular ya que el orbital fronterizo apunta en la dirección del átomo de hidrógeno faltante. Una mayor eliminación de hidrógeno da como resultado la formación de un segundo orbital de frontera. Este proceso se puede repetir hasta que solo quede un enlace con el átomo central de la molécula.
Los fragmentos isolobales de complejos octaédricos , como el tipo ML 6 , se pueden crear de manera similar. Los complejos de metales de transición deben satisfacer inicialmente la regla de los dieciocho electrones , no tener carga neta y sus ligandos deben ser dos donantes de electrones ( bases de Lewis ). En consecuencia, el centro metálico para el punto de partida de ML 6 debe ser d 6 . La eliminación de un ligando es análoga a la eliminación de hidrógeno del metano en el ejemplo anterior, lo que da como resultado un orbital fronterizo que apunta hacia el ligando eliminado. La ruptura del enlace entre el centro metálico y un ligando da como resultado un ML−
5complejo radical. Para satisfacer el criterio de carga cero se debe cambiar el centro metálico. Por ejemplo, un complejo MoL 6 es d 6 y neutro. Sin embargo, eliminar un ligando para formar el orbital de primera frontera daría como resultado un MoL−
5complejo porque Mo ha obtenido un electrón adicional haciéndolo d 7 . Para remediar esto, se puede cambiar Mo por Mn, lo que formaría un complejo d 7 neutro en este caso, como se muestra en la Figura 3. Esta tendencia puede continuar hasta que solo quede un ligando coordinado con el centro metálico.

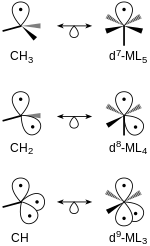
Se pueden relacionar fragmentos isolobales de moléculas tetraédricas y octaédricas. Las estructuras con el mismo número de orbitales fronterizos son isolobas entre sí. Por ejemplo, el metano al que se le han eliminado dos átomos de hidrógeno, CH 2, es isolobal a un complejo de 7 ML 4 formado a partir de un complejo inicial octaédrico (Figura 4).
Cualquier tipo de molécula saturada puede ser el punto de partida para generar fragmentos isolobales. [5] [6] Los orbitales moleculares (MO) enlazantes y no enlazantes de la molécula deben estar llenos y los MO antienlazantes vacíos. Con cada generación consecutiva de un fragmento isolobal, se eliminan electrones de los orbitales enlazantes y se crea un orbital fronterizo. Los orbitales fronterizos tienen un nivel de energía más alto que los OM enlazantes y no enlazantes. Cada orbital de frontera contiene un electrón. Por ejemplo, considere la Figura 5, que muestra la producción de orbitales de frontera en moléculas tetraédricas y octaédricas.

Como se vio arriba, cuando se forma un fragmento a partir de CH 4 , uno de los orbitales híbridos sp 3 involucrados en el enlace se convierte en un orbital de frontera ocupado individualmente y no enlazante. En la figura también se muestra el aumento del nivel de energía del orbital fronterizo. De manera similar, cuando se comienza con un complejo metálico como d 6 -ML 6 , los orbitales híbridos d 2 sp 3 se ven afectados. Además, los orbitales metálicos no enlazantes t 2g están inalterados.
La analogía isolobal tiene aplicaciones más allá de los simples complejos octaédricos. Puede usarse con una variedad de ligandos, especies cargadas y complejos no octaédricos. [7]
La analogía isolobal también se puede utilizar con fragmentos isoelectrónicos que tienen el mismo número de coordinación, lo que permite considerar especies cargadas. Por ejemplo, Re(CO) 5 es isolobal con CH 3 y por lo tanto, [Ru(CO) 5 ] + y [Mo(CO) 5 ] − también son isolobales con CH 3 . Cualquier complejo metálico de 17 electrones sería isolobal en este ejemplo.
En un sentido similar, la adición o eliminación de electrones de dos fragmentos isolobales da como resultado dos nuevos fragmentos isolobales. Dado que Re(CO) 5 es isolobal con CH 3 , [Re(CO) 5 ] + es isolobal con CH+
3. [8]

La analogía se aplica a otras formas además de las geometrías tetraédricas y octaédricas. Las derivaciones utilizadas en geometría octaédrica son válidas para la mayoría de las demás geometrías. La excepción es el plano cuadrado porque los complejos planos cuadrados suelen cumplir con la regla de los 16 electrones. Suponiendo que los ligandos actúan como donantes de dos electrones, el centro metálico en las moléculas planas cuadradas es d 8 . Para relacionar un fragmento octaédrico, ML n , donde M tiene una configuración electrónica ad x con un fragmento análogo plano cuadrado, se debe seguir la fórmula ML n −2 donde M tiene una configuración electrónica ad x +2 .
En la figura 8 se muestran más ejemplos de la analogía isolobal en diversas formas y formas.