Un intermedio tetraédrico es un intermedio de reacción en el que la disposición de los enlaces alrededor de un átomo de carbono inicialmente con doble enlace se ha transformado de trigonal a tetraédrica. [1] Los intermedios tetraédricos resultan de la adición nucleofílica a un grupo carbonilo . La estabilidad del intermedio tetraédrico depende de la capacidad de los grupos unidos al nuevo átomo de carbono tetraédrico para salir con la carga negativa. Los intermedios tetraédricos son muy importantes en la síntesis orgánica y los sistemas biológicos como intermedio clave en la esterificación , transesterificación , hidrólisis de ésteres, formación e hidrólisis de amidas y péptidos , reducciones de hidruros y otras reacciones químicas.
Uno de los primeros relatos del intermedio tetraédrico provino de Rainer Ludwig Claisen en 1887. [2] En la reacción del benzoato de bencilo con metóxido de sodio y del benzoato de metilo con bencilóxido de sodio, observó un precipitado blanco que en condiciones ácidas produce benzoato de bencilo. benzoato de metilo, metanol y alcohol bencílico. Llamó al probable intermedio común " adicional Verbindung ".

Victor Grignard asumió la existencia de un intermedio tetraédrico inestable en 1901, mientras investigaba la reacción de los ésteres con reactivos de organomagnesio. [3]
La primera evidencia de intermediarios tetraédricos en las reacciones de sustitución de derivados carboxílicos la proporcionó Myron L. Bender en 1951. [4] Marcó derivados de ácidos carboxílicos con el isótopo de oxígeno O18 y los hizo reaccionar con agua para producir ácidos carboxílicos marcados. Al final de la reacción encontró que el material de partida restante tenía una proporción disminuida de oxígeno marcado, lo que es consistente con la existencia del intermedio tetraédrico.

El ataque nucleofílico al grupo carbonilo se produce a través de la trayectoria Bürgi-Dunitz . El ángulo entre la línea de ataque nucleofílico y el enlace CO es mayor que 90˚ debido a una mejor superposición orbital entre el HOMO del nucleófilo y el π* LUMO del doble enlace CO.
Aunque los intermedios tetraédricos suelen ser intermedios transitorios, se conocen muchos compuestos de esta estructura general. Las reacciones de aldehídos, cetonas y sus derivados suelen tener un intermedio tetraédrico detectable, mientras que en las reacciones de derivados de ácidos carboxílicos este no es el caso. En el nivel de oxidación de los derivados de ácidos carboxílicos, los grupos como OR, OAr, NR 2 o Cl están conjugados con el grupo carbonilo, lo que significa que la adición al grupo carbonilo es termodinámicamente menos favorecida que la adición al aldehído o cetona correspondiente. Existen intermedios tetraédricos estables de derivados de ácidos carboxílicos y normalmente poseen al menos una de las siguientes cuatro características estructurales:

Estos compuestos se utilizaron para estudiar la cinética de la descomposición intermedia tetraédrica en sus respectivas especies de carbonilo y para medir los espectros IR, UV y RMN del aducto tetraédrico.
Las primeras estructuras cristalinas de rayos X de intermedios tetraédricos se obtuvieron en 1973 a partir de tripsina bovina cristalizada con inhibidor de tripsina pancreática bovina, [9] y en 1974 a partir de tripsina porcina cristalizada con inhibidor de tripsina de soja. [10] En ambos casos, el intermedio tetraédrico se estabiliza en los sitios activos de las enzimas, que han evolucionado para estabilizar el estado de transición de la hidrólisis de péptidos.
Se puede obtener una idea de la estructura del intermedio tetraédrico a partir de la estructura cristalina de la N -brosilmitomicina A, cristalizada en 1967. [11] El carbono tetraédrico C17 forma un enlace de 136,54 pm con O3, que es más corto que el enlace C8-O3 (142,31). pm). Por el contrario, el enlace C17-N2 (149,06 pm) es más largo que el enlace N1-C1 (148,75 pm) y el enlace N1-C11 (147,85 pm) debido a la donación del par solitario O3 al orbital σ* de C17-N2. Sin embargo, este modelo se ve obligado a adoptar un esqueleto tetracíclico y el O3 tetraédrico está metilado, lo que lo convierte en un modelo deficiente en general.

La estructura cristalina de rayos X más reciente de la 1-aza-3,5,7-trimetiladamantan-2-ona es un buen modelo para el intermedio tetraédrico catiónico. [12] El bono C1-N1 es bastante largo [155,2(4) pm], y los bonos C1-O1(2) están acortados [138,2(4) pm]. El átomo de nitrógeno protonado N1 es un gran grupo saliente de amina.
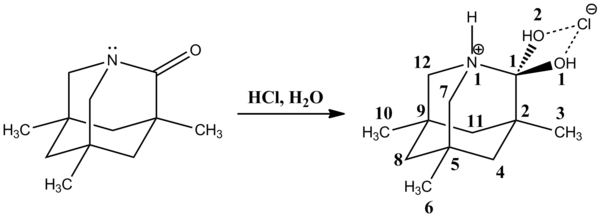
En 2002, David Evans et al. observaron un intermedio tetraédrico neutro muy estable en la reacción de N -acilpirroles con compuestos organometálicos, seguido de protonación con cloruro de amonio produciendo un carbinol. [13] El enlace C1-N1 [147,84(14) pm] es más largo que el enlace pirrol C sp3 -N habitual , que oscila entre 141,2 y 145,8 pm. Por el contrario, el enlace C1-O1 [141,15(13) pm] es más corto que el enlace C sp3 -OH promedio, que mide aproximadamente 143,2 pm. Los enlaces C1-N1 alargados y C1-O1 acortados se explican con un efecto anomérico resultante de la interacción de los pares libres de oxígeno con el orbital σ* CN . De manera similar, una interacción de un par solitario de oxígeno con el orbital σ* CC debería ser responsable del enlace C1-C2 alargado [152,75(15) pm] en comparación con los enlaces C sp2 -C sp2 promedio que son 151,3 pm. Además, el enlace C1-C11 [152,16(17) pm] es ligeramente más corto que el enlace C sp3 -C sp3 promedio , que mide alrededor de 153,0 pm.

Los hemiacetales y acetales son esencialmente intermedios tetraédricos. Se forman cuando los nucleófilos se agregan a un grupo carbonilo, pero a diferencia de los intermedios tetraédricos, pueden ser muy estables y usarse como grupos protectores en química sintética. Una reacción muy conocida ocurre cuando se disuelve acetaldehído en metanol, produciendo un hemiacetal. La mayoría de los hemiacetales son inestables con respecto a sus aldehídos y alcoholes originales. Por ejemplo, la constante de equilibrio para la reacción del acetaldehído con alcoholes simples es aproximadamente 0,5, donde la constante de equilibrio se define como K = [hemiacetal]/[aldehído][alcohol]. Los hemiacetales de cetonas (a veces llamados hemicetales) son incluso menos estables que los de los aldehídos. Sin embargo, los hemiacetales cíclicos y los hemiacetales que llevan grupos aceptores de electrones son estables. Los grupos aceptores de electrones unidos al átomo de carbonilo desplazan la constante de equilibrio hacia el hemiacetal. Aumentan la polarización del grupo carbonilo, que ya tiene un carbono carbonilo polarizado positivamente, y lo hacen aún más propenso al ataque de un nucleófilo. El siguiente cuadro muestra el grado de hidratación de algunos compuestos carbonílicos. La hexafluoroacetona es probablemente el compuesto carbonílico más hidratado posible. El formaldehído reacciona con el agua tan fácilmente porque sus sustituyentes son muy pequeños: un efecto puramente estérico. [14] [15]

Las ciclopropanonas (cetonas con anillos de tres miembros) también se hidratan en gran medida. Dado que los anillos de tres miembros están muy tensos (los ángulos de enlace deben ser de 60°), la hibridación sp 3 es más favorable que la hibridación sp 2 . Para el hidrato con hibridación sp 3 , los enlaces deben distorsionarse aproximadamente 49˚, mientras que para la cetona con hibridación sp 2 la distorsión del ángulo del enlace es de aproximadamente 60˚. Entonces, la adición al grupo carbonilo permite que se libere parte de la tensión inherente al anillo pequeño, razón por la cual la ciclopropanona y la ciclobutanona son electrófilos muy reactivos. Para anillos más grandes, donde los ángulos de enlace no están tan distorsionados, la estabilidad de los hemiacetales se debe a la entropía y a la proximidad del nucleófilo al grupo carbonilo. La formación de un acetal acíclico implica una disminución de la entropía porque se consumen dos moléculas por cada una producida. Por el contrario, la formación de hemiacetales cíclicos implica que una sola molécula reaccione consigo misma, lo que hace que la reacción sea más favorable. Otra forma de entender la estabilidad de los hemiacetales cíclicos es considerar la constante de equilibrio como la relación entre la velocidad de reacción hacia adelante y hacia atrás. Para un hemiacetal cíclico, la reacción es intramolecular, por lo que el nucleófilo siempre se mantiene cerca del grupo carbonilo listo para atacar, por lo que la velocidad de reacción hacia adelante es mucho mayor que la velocidad hacia atrás. Muchos azúcares biológicamente relevantes, como la glucosa , son hemiacetales cíclicos.

En presencia de ácido, los hemiacetales pueden sufrir una reacción de eliminación, perdiendo el átomo de oxígeno que alguna vez perteneció al grupo carbonilo del aldehído original. Estos iones de oxonio son potentes electrófilos y reaccionan rápidamente con una segunda molécula de alcohol para formar compuestos nuevos y estables, llamados acetales. A continuación se detalla todo el mecanismo de formación de acetal a partir de hemiacetal.

Los acetales, como ya se señaló, son intermedios tetraédricos estables por lo que pueden usarse como grupos protectores en síntesis orgánica. Los acetales son estables en condiciones básicas, por lo que pueden usarse para proteger las cetonas de una base. El grupo acetal se hidroliza en condiciones ácidas. A continuación se proporciona un ejemplo con un grupo protector de dioxolano .

Las amidas de Weinreb son amidas del ácido N -metoxi- N -metilcarboxílico. [16] Las amidas de Weinreb se hacen reaccionar con compuestos organometálicos para dar, tras la protonación, cetonas (ver Síntesis de cetonas de Weinreb ). Generalmente se acepta que los altos rendimientos de cetonas se deben a la alta estabilidad del anillo intermedio quelado de cinco miembros. Los cálculos de mecánica cuántica han demostrado que el aducto tetraédrico se forma fácilmente y es bastante estable, de acuerdo con los resultados experimentales. [17] La reacción muy fácil de las amidas de Weinreb con organolitio y reactivos de Grignard resulta de la estabilización del quelato en el aducto tetraédrico y, lo que es más importante, del estado de transición que conduce al aducto. Los aductos tetraédricos se muestran a continuación.

Es probable que un ligando solvatado que se une a la proteína de interés exista como una mezcla en equilibrio de varios confórmeros. Asimismo, la proteína solvatada también existe como varios confórmeros en equilibrio. La formación de un complejo proteína-ligando incluye el desplazamiento de las moléculas de disolvente que ocupan el sitio de unión del ligando, para producir un complejo solvatado. Debido a que esto necesariamente significa que la interacción es entrópicamente desfavorable, los contactos entálpicos altamente favorables entre la proteína y el ligando deben compensar la pérdida entrópica. El diseño de nuevos ligandos suele basarse en la modificación de ligandos conocidos para las proteínas diana. Las proteasas son enzimas que catalizan la hidrólisis de un enlace peptídico. Estas proteínas han evolucionado para reconocer y unirse al estado de transición de la reacción de hidrólisis de péptidos, que es un intermedio tetraédrico. Por lo tanto, los principales inhibidores de proteasas son imitadores intermedios tetraédricos que tienen un alcohol o un grupo fosfato. Algunos ejemplos son saquinavir , ritonavir , pepstatina , etc. [18]
La estabilización de intermedios tetraédricos dentro del sitio activo de la enzima se ha investigado utilizando imitadores de intermedios tetraédricos. Las fuerzas de unión específicas implicadas en la estabilización del estado de transición se han descrito cristalográficamente. En las serina proteasas de mamíferos, tripsina y quimotripsina, dos grupos peptídicos NH de la estructura polipeptídica forman el llamado agujero oxianión donando enlaces de hidrógeno al átomo de oxígeno cargado negativamente del intermedio tetraédrico. [19] A continuación se muestra un diagrama simple que describe la interacción.

{{cite journal}}: Citar diario requiere |journal=( ayuda )