Los anticuerpos humanizados son anticuerpos de especies no humanas cuyas secuencias de proteínas se han modificado para aumentar su similitud con las variantes de anticuerpos producidas naturalmente en humanos. [1] [2] El proceso de "humanización" generalmente se aplica a anticuerpos monoclonales desarrollados para su administración a humanos (por ejemplo, anticuerpos desarrollados como medicamentos contra el cáncer). La humanización puede ser necesaria cuando el proceso de desarrollo de un anticuerpo específico implica la generación en un sistema inmunológico no humano (como el de los ratones). Las secuencias de proteínas de los anticuerpos producidos de esta manera son parcialmente distintas de los anticuerpos homólogos que se producen naturalmente en humanos y, por lo tanto, son potencialmente inmunogénicas cuando se administran a pacientes humanos (ver también Anticuerpos humanos anti-ratón ). Las Denominaciones Comunes Internacionales de los anticuerpos humanizados terminan en -zumab , al igual que en omalizumab (ver Nomenclatura de anticuerpos monoclonales ).
Los anticuerpos humanizados son distintos de los anticuerpos quiméricos . Estos últimos también tienen secuencias de proteínas más similares a las de los anticuerpos humanos, pero contienen una mayor cantidad de proteínas no humanas.
Existen otras formas de desarrollar anticuerpos monoclonales. Esta lista cubre muchos de los monoclonales desarrollados para uso en humanos.
El proceso de humanización aprovecha el hecho de que la producción de anticuerpos monoclonales se puede lograr utilizando ADN recombinante para crear construcciones [3] capaces de expresarse en cultivos de células de mamíferos . Es decir, los segmentos de genes capaces de producir anticuerpos se aíslan y se clonan en células que pueden cultivarse en un biorreactor de modo que las proteínas de anticuerpos producidas a partir del ADN de los genes clonados puedan recolectarse en masa . El paso que implica ADN recombinante proporciona un punto de intervención que puede aprovecharse fácilmente para alterar la secuencia proteica del anticuerpo expresado. Por lo tanto, todas las alteraciones en la estructura de los anticuerpos que se logran en el proceso de humanización se efectúan mediante técnicas a nivel del ADN. No todos los métodos para obtener anticuerpos destinados a la terapia humana requieren un paso de humanización (por ejemplo, presentación en fagos ), pero esencialmente todos dependen de técnicas que permiten de manera similar la "inserción" o el "intercambio" de porciones de la molécula de anticuerpo.
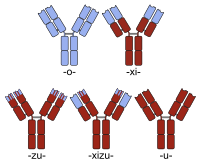
La humanización suele considerarse distinta de la creación de una quimera de anticuerpos humano-ratón . Entonces, aunque la creación de una quimera de anticuerpos normalmente se lleva a cabo para lograr un anticuerpo más parecido al humano (reemplazando la región constante del anticuerpo de ratón con la del humano), las quimeras simples de este tipo generalmente no se denominan humanizadas. Más bien, la secuencia proteica de un anticuerpo humanizado es esencialmente idéntica a la de una variante humana, a pesar del origen no humano de algunos de sus segmentos de la región determinante de la complementariedad (CDR), responsables de la capacidad del anticuerpo para unirse a su antígeno diana. .
Los nombres de anticuerpos quiméricos contienen una raíz -xi- . Ejemplos de anticuerpos quiméricos aprobados para terapia humana incluyen abciximab (ReoPro), basiliximab (Simulect), cetuximab (Erbitux), infliximab (Remicade) y rituximab (MabThera). También hay varios ejemplos de quiméricos actualmente en ensayos clínicos (por ejemplo, bavituximab , consulte la lista ordenable para ver ejemplos adicionales).
El proceso de humanización también puede incluir la creación de una quimera ratón-humano como paso inicial. En este caso, una región variable de ratón se une a una región constante humana. Luego, la quimera puede humanizarse aún más alterando selectivamente la secuencia de aminoácidos en la región variable de la molécula.
El proceso de alteración debe ser "selectivo" para conservar la especificidad para la que se desarrolló originalmente el anticuerpo. Es decir, dado que las porciones CDR de la región variable son esenciales para la capacidad del anticuerpo de unirse a su objetivo previsto, los aminoácidos en estas porciones no pueden alterarse sin el riesgo de socavar el propósito del desarrollo. Además de los segmentos CDR, las partes de las regiones variables que difieren de las del hombre se pueden corregir mediante el intercambio de los aminoácidos individuales correspondientes. Esto se logra a nivel del ADN mediante mutagénesis .
La denominación de quimeras humanizadas incluye la raíz de ambas designaciones ( -xi- + -zu- ). Otelixizumab es un ejemplo de quimera humanizada actualmente en ensayos clínicos para el tratamiento de la artritis reumatoide y la diabetes mellitus . [4]
Es posible producir un anticuerpo humanizado sin crear un intermedio quimérico. La creación "directa" de un anticuerpo humanizado se puede lograr insertando los segmentos codificantes de CDR apropiados (el llamado "donante", responsable de las propiedades de unión deseadas) en un "andamio" de anticuerpo humano (el llamado "aceptor"). Como se analizó anteriormente, esto se logra mediante métodos de ADN recombinante utilizando un vector apropiado [3] y expresión en células de mamíferos. Es decir, después de que se desarrolla un anticuerpo para que tenga las propiedades deseadas en un ratón (u otro no humano), el ADN que codifica ese anticuerpo se puede aislar, clonar en un vector y secuenciar (o el ADN se puede secuenciar directamente usando un solo anticuerpo ). -métodos celulares). A continuación se puede determinar la secuencia de ADN correspondiente a las CDR del anticuerpo. Una vez que se conoce la secuencia precisa de las CDR deseadas, se puede idear una estrategia para insertar estas secuencias apropiadamente en una construcción que contiene el ADN de una variante de anticuerpo humano. [5] [6] [7] [8] [9] La estrategia también puede emplear la síntesis de fragmentos de ADN lineales basados en la lectura de secuencias CDR. El proceso requiere un software de modelado por computadora para determinar cuáles de los aminoácidos del anticuerpo se pueden cambiar de una secuencia murina a una secuencia humana sin que los cambios comprometan la conformación del sitio de unión. En los Estados Unidos, este software fue desarrollado, patentado y demostrado por Protein Design Labs, Inc. en Mountain View, California, en las décadas de 1980 y 1990. [10]
Alemtuzumab es un ejemplo temprano de un anticuerpo cuya humanización no incluyó un intermedio quimérico. En este caso, se desarrolló un monoclonal denominado "Campath-1" para unirse a CD52 utilizando un sistema de ratón. Luego se extrajeron los bucles hipervariables de Campath-1 (que contienen sus CDR y, por lo tanto, imparten su capacidad para unirse a CD52) y se insertaron en una estructura de anticuerpo humano. [1] El alemtuzumab está aprobado para el tratamiento de la leucemia linfocítica crónica de células B [11] y actualmente se encuentra en ensayos clínicos para una variedad de otras afecciones, incluida la esclerosis múltiple . [12]
Existen tecnologías que evitan por completo el uso de ratones u otros mamíferos no humanos en el proceso de descubrimiento de anticuerpos para terapia humana. Ejemplos de tales sistemas incluyen varios métodos de "visualización" (principalmente presentación de fagos ), así como métodos que explotan los niveles elevados de células B que ocurren durante una respuesta inmune humana.
Estos emplean los principios selectivos de la producción de anticuerpos específicos, pero explotan microorganismos (como en la presentación en fagos ) o incluso extractos libres de células (como en la presentación en ribosomas ). Estos sistemas se basan en la creación de "bibliotecas" de genes de anticuerpos que pueden derivarse completamente del ARN humano aislado de sangre periférica . Los productos inmediatos de estos sistemas son fragmentos de anticuerpos, normalmente Fab o scFv .
Esto significa que, aunque los fragmentos de anticuerpos creados mediante métodos de visualización tienen una secuencia completamente humana, no son anticuerpos completos. Por lo tanto, se utilizan procesos en esencia idénticos a la humanización para incorporar y expresar las afinidades derivadas dentro de un anticuerpo completo.
Adalimumab (Humira) es un ejemplo de un anticuerpo aprobado para terapia humana que se creó mediante presentación de fagos. [13] [14]
Es posible aprovechar la reacción inmune humana en el descubrimiento de anticuerpos monoclonales. En pocas palabras, la respuesta inmune humana funciona de la misma manera que la de un ratón u otro mamífero no humano. Por lo tanto, las personas que experimentan un desafío para su sistema inmunológico, como una enfermedad infecciosa, cáncer o una vacuna, son una fuente potencial de anticuerpos monoclonales dirigidos a ese desafío. Este enfoque parece especialmente apto para el desarrollo de terapias antivirales que exploten los principios de la inmunidad pasiva . En principio se han demostrado variantes de este enfoque [15] y algunas están encontrando su camino hacia el desarrollo comercial. [dieciséis]