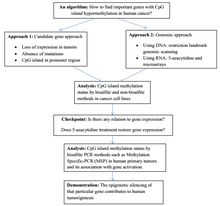
La hipermetilación de las islas CpG es un fenómeno importante para la regulación de la expresión génica en células cancerosas , ya que constituye una aberración del control epigenético responsable de la inactivación génica. La hipermetilación de las islas CpG se ha descrito en casi todos los tipos de tumores .
Muchas vías celulares importantes , como la reparación del ADN (hMLH1, por ejemplo), el ciclo celular ( p14ARF ), la apoptosis ( DAPK ) y la adherencia celular ( CDH1 , CDH13 ), son inactivadas por él. [1] La hipermetilación está vinculada a las proteínas de unión a metilo, las metiltransferasas del ADN y la histona desacetilasa , pero el grado en el que este proceso silencia selectivamente los genes supresores de tumores sigue siendo un área de investigación. La lista de genes hipermetilados está creciendo.
El primer descubrimiento de metilación en una isla CpG de un gen supresor de tumores en humanos fue el del gen del retinoblastoma (Rb) en 1989. [2] Esto fue solo unos años después de que se descubriera la primera mutación de un oncogén en un tumor primario humano. El descubrimiento de la inactivación asociada a la metilación del gen Von Hippel-Lindau (VHL) revivió la idea de que la hipermetilación del promotor de la isla CpG es un mecanismo para inactivar genes en el cáncer. [3] El silenciamiento epigenético del cáncer en su estado actual nació en los laboratorios de Baylin y Jones, [3] donde se demostró que la hipermetilación de la isla CpG era un mecanismo de inactivación común del gen supresor de tumores p16INK4a . La introducción de la PCR específica de metilación y la modificación con bisulfito de sodio agregaron herramientas al cinturón de la investigación de la epigenética del cáncer, [3] [4] y la lista de genes candidatos con metilación aberrante de sus islas CpG ha estado creciendo desde entonces. [5] Inicialmente, la presencia de alteraciones en el perfil de metilación del ADN en el cáncer se consideró como una hipometilación global del genoma que llevaría a una sobreexpresión masiva de oncogenes con una isla CpG normalmente hipermetilada. [6] Últimamente, esto se considera como un escenario incompleto, a pesar de que la idea de que el genoma de la célula cancerosa sufre una reducción de su contenido de 5-metilcitosina en comparación con su célula normal parental es correcta. [5] En los tejidos normales, la gran mayoría de las islas CpG están completamente desmetiladas con algunas excepciones. [1] La asociación del silenciamiento transcripcional de los genes supresores de tumores con la hipermetilación es la base sobre la que se sostiene este subconjunto de la epigenética del cáncer.
En una célula normal, la isla CpG está hipometilada, [7] y el resto del genoma está metilado. Es evidente que la hipometilación de la isla CpG en células normales no proporciona ningún impedimento estérico adicional para la unión futura. La mayoría de los pares CpG en mamíferos están modificados químicamente por la unión covalente de un grupo metilo a la posición C5 del anillo de citosina . [8] Esta modificación se distribuye por todo el genoma y reprime la transcripción. Una isla CpG es una citosina y guanina unidas por un fosfato en una secuencia repetida. Estos son puntos críticos genéticos ya que son sitios de metilación activa . La expresión de un gen es específica de tejido , lo que conduce a la variación en la función del tejido. La metilación de un gen impide la expresión de un gen de una manera particular.
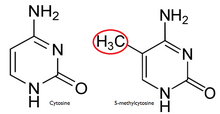
La razón por la que la metilación es casi exclusiva de los dinucleótidos CpG es la simetría del dinucleótido, que permite su conservación durante la división celular y es un sello distintivo de las modificaciones epigenéticas.

Las islas CpG que están hipermetiladas pueden desempeñar tres papeles en el cáncer: en el diagnóstico , el pronóstico y el seguimiento . Es útil considerar un tipo particular de tumor, llamado fenotipo metilador de islas CpG o CIMP: se encuentran niveles más altos de hipermetilación de islas CpG en CIMP. La aparición frecuente de hipermetilación se describió por primera vez en el cáncer colorrectal y más tarde para el glioma . Más recientemente, se ha estudiado para los neuroblastomas . El cáncer colorrectal no necesariamente tendrá el mismo conjunto de islas CpG hipermetiladas que en un glioma, y esta distinción clínica de los tumores puede ser interpretada por los médicos. Las islas CpG hipermetiladas también actúan como biomarcadores , ya que pueden ayudar a distinguir el cáncer de las células normales en la misma muestra.
El CIMP colorrectal fue uno de los primeros en describirse. Los pacientes de esta categoría de cáncer tienden a ser mayores, mujeres y tienen una función defectuosa de MLH1 . Los tumores suelen estar en el colon ascendente. También tienen un buen pronóstico. Los fenotipos clínicamente distintos del CIMP también sugieren que existe potencial para la terapia epigenética .
En el diagnóstico, se puede identificar el tipo y subtipo de tumor, así como su tumor primario cuando se desconoce. La hipermetilación aumenta con la tumorigenicidad , lo que es una indicación del pronóstico del cáncer. Por ejemplo, la metilación alta es un marcador de mal pronóstico en el cáncer de pulmón. La hipermetilación de las islas CpG es prometedora para el seguimiento molecular de los pacientes con cáncer y también es un objetivo potencial para el uso terapéutico.

Las aberraciones en el control epigenético que se observan en el cáncer se relacionan con la metilación del ADN , que puede ser hipermetilación del ADN específica del locus o hipometilación del ADN a nivel de todo el genoma . Bajo la hipermetilación del ADN específica del locus se encuentra la hipermetilación de islas CpG . La metilación del ADN actúa como una alternativa a la mutación genética . Según la hipótesis de Knudson , el cáncer es el resultado de múltiples impactos en el ADN, y la metilación del ADN puede ser uno de esos impactos. Las mutaciones epigenéticas como la metilación del ADN son hereditarias mitóticamente , pero también reversibles, a diferencia de las mutaciones genéticas. La identidad de las islas CpG hipermetiladas varía según el tipo de tumor. Algunos ejemplos de genes únicos incluyen MLH1 en el cáncer colorrectal y BRCA1 en el cáncer de mama .