
En química , un ácido fosfórico , en sentido general, es un oxoácido de fósforo en el que cada átomo de fósforo (P) está en estado de oxidación +5, y está unido a cuatro átomos de oxígeno (O), uno de ellos a través de un doble enlace , dispuestos como los vértices de un tetraedro . Dos o más de estos tetraedros PO4 pueden estar conectados por oxígenos compartidos con un solo enlace, formando cadenas lineales o ramificadas , ciclos o estructuras más complejas. Los átomos de oxígeno con un solo enlace que no se comparten se completan con átomos de hidrógeno ácidos . La fórmula general de un ácido fosfórico es H n +2−2 x P n O 3 n +1− x , donde n es el número de átomos de fósforo y x es el número de ciclos fundamentales en la estructura de la molécula, entre 0 y n +2/2 .

La eliminación de protones ( H + ) de los grupos hidroxilo k –OH deja aniones denominados genéricamente fosfatos (si k = n − 2 x + 2 ) o hidrogenofosfatos (si k está entre 1 y n − 2 x + 1 ), con fórmula general [H n −2 x +2− k P n O 3 n +1− x ] k − . El anión completamente disociado ( k = n − 2 x + 2 ) tiene fórmula [P n O 3 n − x +1 ] ( n −2 x +2)− . El término fosfato también se utiliza en química orgánica para los grupos funcionales que resultan cuando uno o más de los hidrógenos son reemplazados por enlaces a otros grupos.
Estos ácidos, junto con sus sales y ésteres , incluyen algunos de los compuestos más conocidos del fósforo, de gran importancia en bioquímica , mineralogía , agricultura , farmacia , industria química e investigación química .
El ácido fosfórico más simple y más común es el ácido ortofosfórico , H3PO4 . De hecho, el término ácido fosfórico a menudo se refiere específicamente a este compuesto (y esta es también la nomenclatura actual de la IUPAC ). [ cita requerida ]

Dos o más moléculas de ácido ortofosfórico pueden unirse por condensación para formar moléculas más grandes mediante la eliminación de agua . La condensación de unas pocas unidades produce los ácidos oligofosfóricos , mientras que las moléculas más grandes se denominan ácidos polifosfóricos . (Sin embargo, la distinción entre los dos términos no está bien definida).
Por ejemplo, los ácidos pirofosfórico , trifosfórico y tetrafosfórico se pueden obtener mediante las reacciones
La "columna vertebral" de una molécula de ácido polifosfórico es una cadena de átomos de P y O alternados. Cada unidad ortofosfórica adicional que se condensa agrega 1 átomo de H ( hidrógeno ) adicional, 1 átomo de P ( fósforo ) adicional y 3 átomos de O ( oxígeno ) adicionales. La fórmula general de un ácido polifosfórico es H n +2 P n O 3 n +1 o HO[−P(O)(OH)−O−] n H .
Los ácidos polifosfóricos se utilizan en síntesis orgánica para ciclizaciones y acilaciones ; una alternativa es el reactivo de Eaton . [1] [2] [3]
El ácido metafosfórico ( HPO 3 ) es un sólido vítreo, delicuescente e incoloro, de densidad 2,2 a 2,5 g/cc, que sublima al calentarse. Es soluble en etanol. [4]

Las unidades de ácido fosfórico pueden unirse entre sí en anillos (estructuras cíclicas). El compuesto más simple de este tipo es el ácido trimetafosfórico o ácido ciclotrifosfórico, que tiene la fórmula H 3 P 3 O 9 . Su estructura se muestra en la ilustración. Como los extremos están condensados, su fórmula tiene un H 2 O (agua) menos que el ácido tripolifosfórico.
La fórmula general de un ácido fosfórico es H n −2 x +2 P n O 3 n − x +1 , donde n es el número de átomos de fósforo y x es el número de ciclos fundamentales en la estructura de la molécula; es decir, el número mínimo de enlaces que habría que romper para eliminar todos los ciclos.
El caso límite de condensación interna, donde se comparten todos los átomos de oxígeno y no hay átomos de hidrógeno ( x = número +2/2 ) es un anhídrido P 2 n O 5 n , pentóxido de fósforo P 4 O 10 .
La eliminación de los átomos de hidrógeno como protones H + convierte el ácido fosfórico en un anión fosfato. La eliminación parcial produce varios aniones de fosfato de hidrógeno.
Los aniones del ácido ortofosfórico H 3 PO 4 son ortofosfato (comúnmente llamado simplemente "fosfato") PO3−4, fosfato monohidrógeno HPO2−4, y fosfato de dihidrógeno H 2 PO−4.
La disociación del ácido pirofosfórico H 4 P 2 O 7 genera cuatro aniones, [H 4− k P 2 O 7 ] k − , donde la carga k varía de 1 a 4. El último es el pirofosfato [P 2 O 7 ] 4− . Los pirofosfatos son en su mayoría solubles en agua.
De la misma manera, el ácido tripolifosfórico H 5 P 3 O 10 produce al menos cinco aniones [H 5− k P 3 O 10 ] k − , donde k varía de 1 a 5, incluido el tripolifosfato [P 3 O 10 ] 5− . El ácido tetrapolifosfórico H 6 P 4 O 13 produce al menos seis aniones, incluido el tetrapolifosfato [P 4 O 13 ] 6− , y así sucesivamente. Nótese que cada unidad fosfórica adicional agrega un átomo de P adicional, tres átomos de O adicionales y un átomo de hidrógeno adicional o una carga negativa adicional.
Los ácidos polifosfóricos ramificados dan lugar a aniones polifosfatos ramificados de forma similar. El ejemplo más simple de esto es el trifosfonofosfato [OP(OPO 3 ) 3 ] 9− y sus versiones parcialmente disociadas.
La fórmula general para dichos aniones polifosfato (no cíclicos), lineales o ramificados, es [H n +2− k P n O 3 n +1 ] k − , donde la carga k puede variar de 1 a n + 2 . Generalmente en una solución acuosa, el grado o porcentaje de disociación depende del pH de la solución.
Las sales o ésteres de ácidos polifosfóricos cíclicos se denominan a menudo "metafosfatos". Los llamados trimetafosfatos en realidad tienen una mezcla de tamaños de anillos. Una fórmula general para estos compuestos cíclicos es [HPO 3 ] x donde x = número de unidades fosfóricas en la molécula.
Cuando los ácidos metafosfóricos pierden sus hidrógenos en forma de H + , se forman aniones cíclicos llamados metafosfatos . Un ejemplo de un compuesto con un anión de este tipo es el hexametafosfato de sodio ( Na6P6O18 ), utilizado como secuestrante y aditivo alimentario .
Estas series de ácidos fosfóricos son generalmente solubles en agua considerando la polaridad de las moléculas. Los fosfatos de amonio y alcalinos también son bastante solubles en agua. Las sales alcalinotérreas comienzan a volverse menos solubles y las sales de fosfato de varios otros metales son aún menos solubles.
En soluciones acuosas (soluciones de agua), el agua hidroliza gradualmente (en el transcurso de horas) los polifosfatos en fosfatos más pequeños y finalmente en ortofosfato, si se le suministra suficiente agua. Una temperatura más alta o condiciones ácidas pueden acelerar considerablemente las reacciones de hidrólisis . [5]
Por el contrario, los ácidos polifosfóricos o polifosfatos a menudo se forman deshidratando una solución de ácido fosfórico; en otras palabras, eliminando agua de ella, generalmente calentándola y evaporando el agua.
Los compuestos de orto-, piro- y tripolifosfato se han utilizado comúnmente en formulaciones de detergentes (es decir, limpiadores). Por ejemplo, consulte Tripolifosfato de sodio . A veces, el pirofosfato, tripolifosfato, tetrapolifosfato, etc. se denominan difosfato , trifosfato , tetrafosfato , etc., especialmente cuando forman parte de ésteres de fosfato en bioquímica . También se utilizan para el control de incrustaciones y corrosión por parte de los proveedores de agua potable . [6] Como inhibidores de corrosión, los polifosfatos funcionan formando una película protectora en la superficie interior de las tuberías. [7]
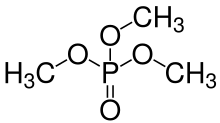
Los grupos -OH en los ácidos fosfóricos también pueden condensarse con los grupos hidroxilo de los alcoholes para formar ésteres de fosfato . Dado que el ácido ortofosfórico tiene tres grupos -OH , puede esterificarse con una, dos o tres moléculas de alcohol para formar un mono-, di- o triéster. Vea la imagen de la estructura general de un orto- (o mono-) éster de fosfato a continuación a la izquierda, donde cualquiera de los grupos R puede ser un hidrógeno o un radical orgánico . También son posibles los ésteres de di- y tripoli- (o tri-)fosfato, etc. Cualquier grupo -OH en los fosfatos en estas moléculas de éster puede perder iones H + para formar aniones, nuevamente dependiendo del pH en una solución. En la bioquímica de los organismos vivos, hay muchos tipos de compuestos (mono)fosfato, difosfato y trifosfato (esencialmente ésteres ), muchos de los cuales juegan un papel significativo en el metabolismo, como el difosfato de adenosina (ADP) y el trifosfato (ATP) .
