Un fenestrano en química orgánica es un tipo de compuesto químico con un átomo de carbono cuaternario central que sirve como vértice común para cuatro carbociclos fusionados . [1] Pueden considerarse compuestos espiro por partida doble. Debido a su tensión e inestabilidad inherentes, los fenestranos son de interés teórico para los químicos. El nombre, propuesto en 1972 por Vlasios Georgian y Martin Saltzman [2] , se deriva de la palabra latina para ventana , fenestra . Georgian había pretendido que "fenestrano" se refiriera únicamente al [4.4.4.4]fenestrano, cuya estructura esquelética se parece a las ventanas, y Kenneth B. Wiberg llamó a esa estructura específica "cristal de ventana". [3] Desde entonces, el término fenestrano se ha generalizado para referirse a toda la clase de moléculas que tienen varios tamaños de anillo diferentes. Georgian recomendó el rosetano para la clase, basándose en la apariencia estructural como una roseta de flores . [3]


Las estructuras dentro de esta clase de sustancias químicas pueden nombrarse según el número de átomos en cada anillo, además de la nomenclatura sistemática de las reglas de nomenclatura de la IUPAC . El miembro más pequeño de la familia, que consta de cuatro anillos de ciclopropano fusionados , es [3.3.3.3]fenestrano, que tiene el nombre sistemático tetraciclo[2.1.0.0 1,3 .0 2,5 ]pentano y también se llama piramidano. El siguiente miembro simétrico, [4.4.4.4]fenestrano, tiene cuatro anillos de ciclobutano fusionados y tiene el nombre sistemático tetraciclo[3.3.1.0 3,9 .0 7,9 ]nonano. No es necesario que todos los anillos tengan el mismo tamaño, por lo que [4.4.4.5]fenestrano tiene tres anillos de ciclobutano y un anillo de ciclopentano . Otras modificaciones estructurales varían el nombre como es habitual en la nomenclatura sistemática, por lo que un [4.6.4.6]fenestradieno tiene dos anillos de ciclobutano y dos anillos de ciclohexano en un patrón alterno y dos unidades de alqueno en la estructura del anillo.
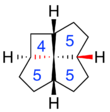
Además de los tamaños de los anillos, los fenestranos pueden tener varias combinaciones de geometría cis y trans en cada fusión de anillos. Estos detalles se indican con los prefijos " c " y " t " en el nombre de la estructura, que se enumeran en el mismo orden que los tamaños de los anillos. [4] Por ejemplo, c , t , c , c -[4.5.5.5]fenestrano tiene una configuración trans en una de las fusiones ciclopentano/ciclopentano, pero una configuración cis en la otra fusión ciclopentano/ciclopentano y en ambas fusiones butanopentano/ciclopentano.
En un caso extremo [ aclaración necesaria ] el átomo de carbono central, que normalmente tendría una geometría molecular tetraédrica para sus cuatro enlaces, se aplana por completo. En la imagen de orbitales moleculares para la geometría plana cuadrada resultante del metano , dos de un total de tres orbitales atómicos de carbono hibridados sp2 forman enlaces regulares con dos de los átomos de hidrógeno como en un alqueno plano . El tercer orbital sp2 interactúa en un enlace de dos electrones de tres centros con los dos átomos de hidrógeno restantes utilizando solo los electrones de hidrógeno. Dos electrones de valencia de carbono adicionales están situados en un orbital p perpendicular al plano de la molécula. Los cuatro enlaces C–H son iguales debido a la resonancia . Los cálculos in silico muestran que se necesitan de 95 a 250 kcal/mol (400 a 1.050 kJ/mol) para este proceso. [ cita requerida ]
Uno de los fenestranos más deformados que se han aislado es un [4.4.4.5]fenestrano con ángulos de enlace en el átomo de carbono central de alrededor de 130° (según la cristalografía de rayos X ), en comparación con el estándar de 109,45° para átomos tetraédricos. Las longitudes de enlace carbono-carbono también se desvían de las de los alcanos normales. Mientras que el enlace C-C en el etano es de 155 pm, en este fenestrano, los enlaces que se extienden desde el átomo de carbono central se acortan a 149 pm, mientras que los del perímetro se alargan a 159 pm. [5]
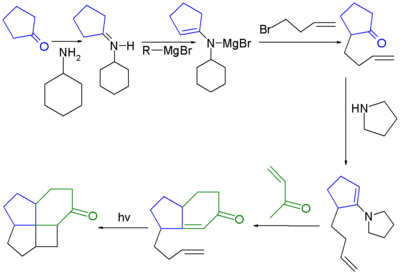
Un diterpeno llamado laureneno que contiene un sistema de anillo [5.5.5.7]fenestrano fue el primer fenestrano natural que se descubrió. [6] [7] El primer fenestrano sintetizado fue un [4.5.5.6]fenestrano: [2] [8]
El piramidano ([3.3.3.3]fenestrano) es el fenestrano más pequeño posible y nunca se ha sintetizado. Si el carbono central fuera tetraédrico, tendría la forma de espiropentadieno , pero con enlaces adicionales entre los dos anillos de ciclopropilo en lugar de dobles enlaces dentro de ellos. Por otro lado, se han sintetizado los germa- y estannapiramidanos análogos, con grupos trimetilsililo unidos a las esquinas, Ge[C 4 (SiMe 3 ) 4 ] y Sn[C 4 (SiMe 3 ) 4 ]. [9] Estos adoptan una geometría piramidal cuadrada análoga a la pirámide trigonal del tetraedro , con el átomo de germanio o estaño en el vértice. Ese átomo tiene una geometría tetraédrica invertida . Según el análisis de resonancia magnética nuclear , los cuatro carbonos de la base de la pirámide se comportan como un anillo aromático .
En un estudio, se sintetizó un [4.5.5.5]fenestrano con un átomo de carbono reemplazado por nitrógeno porque los compuestos aza- y sus sales tienen más probabilidades de formar compuestos cristalinos adecuados para el análisis de rayos X que los alcanos de bajo peso molecular. [4] En el paso 1, el haluro de alquilo 1-yodo-3-buteno 1 se convierte en un cuprato de cianocinc 2 (por transmetalación del yoduro de organocinc con cianuro de cobre ) que reacciona en el siguiente paso con 1-nitrociclopenteno 3 en una adición nucleofílica por la cual el nitronato 4 es capturado por bromuro de fenilselenilo al intermedio de selenio 5. La oxidación con peróxido de hidrógeno de 5 produce el nitroalqueno 6 como una mezcla de isómeros syn y anti . Una cicloadición [4+2] con n -butil enol éter en presencia de trimetilaluminio da el nitronato 7 y una segunda cicloadición [3+2] mediante calentamiento en presencia de carbonato de potasio da el nitroso acetal 8. La hidrogenación con níquel Raney da el diol 9 que en una doble reacción de Mitsunobu (con un donador de protones de amina) da el azafenestrano 10 como sal de borano .

En la sal de borano el ángulo de enlace N–C–C es 126°.
Un estudio describe una reacción en cascada electrocíclica inusual de 8π disrotatoria y 6π conrotatoria cuyo objetivo es minimizar la cantidad de pasos necesarios para sintetizar un fenestrano. [10] [11]
