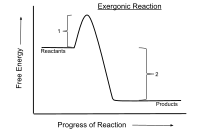
En termodinámica química , una reacción exergónica es una reacción química en la que el cambio en la energía libre es negativo (hay una liberación neta de energía libre). [1] Esto indica una reacción espontánea si el sistema está cerrado y las temperaturas inicial y final son las mismas. Para los procesos que tienen lugar en un sistema cerrado a presión y temperatura constantes, se utiliza la energía libre de Gibbs , mientras que la energía de Helmholtz es relevante para los procesos que tienen lugar a volumen y temperatura constantes. Cualquier reacción que ocurra a temperatura constante sin entrada de energía eléctrica o fotónica es exergónica, de acuerdo con la segunda ley de la termodinámica . Un ejemplo es la respiración celular .
Simbólicamente, la liberación de energía libre, , en una reacción exergónica (a presión y temperatura constantes) se denota como
Aunque se dice que las reacciones exergónicas ocurren espontáneamente , esto no implica que la reacción se lleve a cabo a una velocidad observable . Por ejemplo, la desproporción de peróxido de hidrógeno libera energía libre, pero es muy lenta en ausencia de un catalizador adecuado. Se ha sugerido que ansioso sería un término más intuitivo en este contexto. [2]
En términos más generales, los términos exergónico y endergónico se relacionan con el cambio de energía libre en cualquier proceso, no solo en las reacciones químicas. Por el contrario, los términos exotérmico y endotérmico se relacionan con un cambio de entalpía en un sistema cerrado durante un proceso, generalmente asociado con el intercambio de calor .