
La espectroscopia de absorción es una espectroscopia que implica técnicas que miden la absorción de la radiación electromagnética , en función de la frecuencia o la longitud de onda , debido a su interacción con una muestra. La muestra absorbe energía, es decir, fotones, del campo radiante. La intensidad de la absorción varía en función de la frecuencia, y esta variación es el espectro de absorción. La espectroscopia de absorción se realiza a lo largo del espectro electromagnético .
La espectroscopia de absorción se utiliza como herramienta de química analítica para determinar la presencia de una sustancia particular en una muestra y, en muchos casos, para cuantificar la cantidad de la sustancia presente. La espectroscopia infrarroja y ultravioleta-visible son particularmente comunes en aplicaciones analíticas. La espectroscopia de absorción también se utiliza en estudios de física molecular y atómica, espectroscopia astronómica y teledetección.
Existe una amplia gama de métodos experimentales para medir los espectros de absorción. La disposición más común consiste en dirigir un haz de radiación generado hacia una muestra y detectar la intensidad de la radiación que pasa a través de ella. La energía transmitida se puede utilizar para calcular la absorción. La fuente, la disposición de la muestra y la técnica de detección varían significativamente según el rango de frecuencia y el propósito del experimento.
Los siguientes son los principales tipos de espectroscopia de absorción: [1]

El espectro de absorción de un material es la fracción de radiación incidente absorbida por el material en un rango de frecuencias de radiación electromagnética. El espectro de absorción está determinado principalmente [2] [3] [4] por la composición atómica y molecular del material. Es más probable que la radiación se absorba en frecuencias que coincidan con la diferencia de energía entre dos estados mecánicos cuánticos de las moléculas. La absorción que se produce debido a una transición entre dos estados se conoce como línea de absorción y un espectro generalmente se compone de muchas líneas.
Las frecuencias a las que se producen las líneas de absorción, así como sus intensidades relativas, dependen principalmente de la estructura electrónica y molecular de la muestra. Las frecuencias también dependerán de las interacciones entre las moléculas de la muestra, de la estructura cristalina de los sólidos y de varios factores ambientales (por ejemplo, temperatura , presión , campo eléctrico , campo magnético ). Las líneas también tendrán un ancho y una forma que están determinados principalmente por la densidad espectral o la densidad de estados del sistema.
Es una rama de los espectros atómicos donde, Las líneas de absorción se clasifican típicamente por la naturaleza del cambio mecánico cuántico inducido en la molécula o átomo. Las líneas rotacionales , por ejemplo, ocurren cuando se cambia el estado rotacional de una molécula. Las líneas rotacionales se encuentran típicamente en la región espectral de microondas. Las líneas vibracionales corresponden a cambios en el estado vibracional de la molécula y se encuentran típicamente en la región infrarroja. Las líneas electrónicas corresponden a un cambio en el estado electrónico de un átomo o molécula y se encuentran típicamente en la región visible y ultravioleta. Las absorciones de rayos X están asociadas con la excitación de los electrones de la capa interna en los átomos. Estos cambios también se pueden combinar (por ejemplo, transiciones de rotación-vibración ), lo que lleva a nuevas líneas de absorción en la energía combinada de los dos cambios.
La energía asociada con el cambio mecánico cuántico determina principalmente la frecuencia de la línea de absorción, pero la frecuencia puede variar debido a varios tipos de interacciones. Los campos eléctricos y magnéticos pueden provocar un cambio. Las interacciones con moléculas vecinas pueden provocar cambios. Por ejemplo, las líneas de absorción de la molécula en fase gaseosa pueden variar significativamente cuando esa molécula está en fase líquida o sólida e interactúa más fuertemente con las moléculas vecinas.
El ancho y la forma de las líneas de absorción están determinados por el instrumento utilizado para la observación, el material que absorbe la radiación y el entorno físico de ese material. Es habitual que las líneas tengan la forma de una distribución gaussiana o lorentziana . También es habitual que una línea se describa únicamente por su intensidad y ancho en lugar de caracterizar toda su forma.
La intensidad integrada, que se obtiene al integrar el área bajo la línea de absorción, es proporcional a la cantidad de sustancia absorbente presente. La intensidad también está relacionada con la temperatura de la sustancia y la interacción mecánica cuántica entre la radiación y el absorbente. Esta interacción se cuantifica mediante el momento de transición y depende del estado inferior particular desde el que comienza la transición y del estado superior al que está conectada.
El ancho de las líneas de absorción puede estar determinado por el espectrómetro utilizado para registrarlas. Un espectrómetro tiene un límite inherente en cuanto a la estrechez de la línea que puede resolver , por lo que el ancho observado puede estar en este límite. Si el ancho es mayor que el límite de resolución, entonces está determinado principalmente por el entorno del absorbente. Un absorbente líquido o sólido, en el que las moléculas vecinas interactúan fuertemente entre sí, tiende a tener líneas de absorción más anchas que un gas. El aumento de la temperatura o la presión del material absorbente también tenderá a aumentar el ancho de la línea. También es común que varias transiciones vecinas estén lo suficientemente cerca una de otra como para que sus líneas se superpongan y, por lo tanto, la línea general resultante sea aún más ancha.
Los espectros de absorción y transmisión representan información equivalente y uno puede calcularse a partir del otro mediante una transformación matemática. Un espectro de transmisión tendrá sus intensidades máximas en longitudes de onda donde la absorción es más débil porque se transmite más luz a través de la muestra. Un espectro de absorción tendrá sus intensidades máximas en longitudes de onda donde la absorción es más fuerte.

La emisión es un proceso por el cual una sustancia libera energía en forma de radiación electromagnética. La emisión puede ocurrir en cualquier frecuencia en la que pueda ocurrir la absorción, y esto permite determinar las líneas de absorción a partir de un espectro de emisión. Sin embargo, el espectro de emisión generalmente tendrá un patrón de intensidad bastante diferente del espectro de absorción, por lo que los dos no son equivalentes. El espectro de absorción se puede calcular a partir del espectro de emisión utilizando coeficientes de Einstein .
Los espectros de dispersión y reflexión de un material están influenciados tanto por su índice de refracción como por su espectro de absorción. En un contexto óptico, el espectro de absorción se cuantifica típicamente mediante el coeficiente de extinción , y los coeficientes de extinción e índice están relacionados cuantitativamente a través de las relaciones de Kramers-Kronig . Por lo tanto, el espectro de absorción se puede derivar de un espectro de dispersión o reflexión. Esto generalmente requiere suposiciones o modelos simplificados, por lo que el espectro de absorción derivado es una aproximación.

La espectroscopia de absorción es útil en el análisis químico [5] debido a su especificidad y su naturaleza cuantitativa. La especificidad de los espectros de absorción permite distinguir los compuestos entre sí en una mezcla, lo que hace que la espectroscopia de absorción sea útil en una amplia variedad de aplicaciones. Por ejemplo, los analizadores de gases infrarrojos se pueden utilizar para identificar la presencia de contaminantes en el aire, distinguiendo el contaminante del nitrógeno, el oxígeno, el agua y otros componentes esperados. [6]
La especificidad también permite identificar muestras desconocidas comparando un espectro medido con una biblioteca de espectros de referencia. En muchos casos, es posible determinar información cualitativa sobre una muestra incluso si no se encuentra en una biblioteca. Los espectros infrarrojos, por ejemplo, tienen bandas de absorción características que indican si hay enlaces carbono-hidrógeno o carbono-oxígeno.
Un espectro de absorción se puede relacionar cuantitativamente con la cantidad de material presente utilizando la ley de Beer-Lambert . Para determinar la concentración absoluta de un compuesto es necesario conocer el coeficiente de absorción del compuesto . El coeficiente de absorción de algunos compuestos está disponible en fuentes de referencia y también se puede determinar midiendo el espectro de un estándar de calibración con una concentración conocida del objetivo.
Una de las ventajas exclusivas de la espectroscopia como técnica analítica es que las mediciones se pueden realizar sin poner en contacto el instrumento y la muestra. La radiación que viaja entre una muestra y un instrumento contendrá la información espectral, por lo que la medición se puede realizar de forma remota . La detección espectral remota es valiosa en muchas situaciones. Por ejemplo, las mediciones se pueden realizar en entornos tóxicos o peligrosos sin poner en riesgo al operador o al instrumento. Además, el material de la muestra no tiene que entrar en contacto con el instrumento, lo que evita la posible contaminación cruzada.
Las mediciones espectrales remotas presentan varios desafíos en comparación con las mediciones de laboratorio. El espacio entre la muestra de interés y el instrumento también puede tener absorciones espectrales. Estas absorciones pueden enmascarar o confundir el espectro de absorción de la muestra. Estas interferencias de fondo también pueden variar con el tiempo. La fuente de radiación en las mediciones remotas suele ser una fuente ambiental, como la luz solar o la radiación térmica de un objeto cálido, y esto hace que sea necesario distinguir la absorción espectral de los cambios en el espectro de la fuente.
Para simplificar estos desafíos, la espectroscopia de absorción óptica diferencial ha ganado cierta popularidad, ya que se centra en las características de absorción diferencial y omite la absorción de banda ancha, como la extinción de aerosoles y la extinción debido a la dispersión de Rayleigh. Este método se aplica a mediciones terrestres, aéreas y satelitales. Algunos métodos terrestres brindan la posibilidad de recuperar perfiles de gases traza troposféricos y estratosféricos.

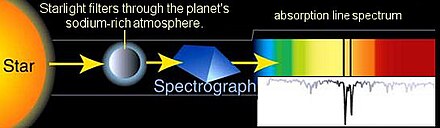
La espectroscopia astronómica es un tipo particularmente significativo de detección espectral remota. En este caso, los objetos y muestras de interés están tan distantes de la Tierra que la radiación electromagnética es el único medio disponible para medirlos. Los espectros astronómicos contienen información espectral tanto de absorción como de emisión. La espectroscopia de absorción ha sido particularmente importante para comprender las nubes interestelares y determinar que algunas de ellas contienen moléculas . La espectroscopia de absorción también se emplea en el estudio de planetas extrasolares . La detección de planetas extrasolares por fotometría de tránsito también mide su espectro de absorción y permite la determinación de la composición atmosférica del planeta, [7] temperatura, presión y altura de escala , y por lo tanto también permite la determinación de la masa del planeta. [8]
Los modelos teóricos, principalmente los modelos mecánicos cuánticos , permiten relacionar los espectros de absorción de átomos y moléculas con otras propiedades físicas como la estructura electrónica , la masa atómica o molecular y la geometría molecular . Por ello, las mediciones del espectro de absorción se utilizan para determinar estas otras propiedades. La espectroscopia de microondas , por ejemplo, permite determinar longitudes y ángulos de enlace con gran precisión.
Además, las mediciones espectrales se pueden utilizar para determinar la precisión de las predicciones teóricas. Por ejemplo, no se esperaba que existiera el desplazamiento Lamb medido en el espectro de absorción atómica del hidrógeno en el momento en que se midió. Su descubrimiento estimuló y guió el desarrollo de la electrodinámica cuántica , y las mediciones del desplazamiento Lamb se utilizan ahora para determinar la constante de estructura fina .
El método más sencillo para la espectroscopia de absorción consiste en generar radiación con una fuente, medir un espectro de referencia de esa radiación con un detector y, a continuación, volver a medir el espectro de la muestra tras colocar el material de interés entre la fuente y el detector. A continuación, los dos espectros medidos se pueden combinar para determinar el espectro de absorción del material. El espectro de la muestra por sí solo no es suficiente para determinar el espectro de absorción, ya que se verá afectado por las condiciones experimentales (el espectro de la fuente, los espectros de absorción de otros materiales entre la fuente y el detector y las características dependientes de la longitud de onda del detector). Sin embargo, el espectro de referencia se verá afectado de la misma manera por estas condiciones experimentales y, por tanto, la combinación da como resultado el espectro de absorción del material solo.
Se emplea una amplia variedad de fuentes de radiación para cubrir el espectro electromagnético. Para la espectroscopia, generalmente es deseable que una fuente cubra una amplia franja de longitudes de onda para medir una amplia región del espectro de absorción. Algunas fuentes emiten inherentemente un espectro amplio. Ejemplos de estas incluyen globos u otras fuentes de cuerpo negro en el infrarrojo, lámparas de mercurio en el visible y ultravioleta, y tubos de rayos X. Una fuente novedosa de radiación de amplio espectro desarrollada recientemente es la radiación de sincrotrón , que cubre todas estas regiones espectrales. Otras fuentes de radiación generan un espectro estrecho, pero la longitud de onda de emisión se puede ajustar para cubrir un rango espectral. Ejemplos de estos incluyen klistrones en la región de microondas y láseres en la región infrarroja, visible y ultravioleta (aunque no todos los láseres tienen longitudes de onda ajustables).
El detector empleado para medir la potencia de la radiación también dependerá del rango de longitud de onda de interés. La mayoría de los detectores son sensibles a un rango espectral bastante amplio y el sensor seleccionado dependerá a menudo más de los requisitos de sensibilidad y ruido de una medición determinada. Entre los ejemplos de detectores comunes en espectroscopia se incluyen los receptores heterodinos en el microondas, los bolómetros en las ondas milimétricas y el infrarrojo, los detectores de telururo de mercurio y cadmio y otros semiconductores refrigerados en el infrarrojo, y los fotodiodos y tubos fotomultiplicadores en el visible y el ultravioleta.
Si tanto la fuente como el detector cubren una amplia región espectral, entonces también es necesario introducir un medio para resolver la longitud de onda de la radiación a fin de determinar el espectro. A menudo se utiliza un espectrógrafo para separar espacialmente las longitudes de onda de la radiación, de modo que la potencia en cada longitud de onda se pueda medir de forma independiente. También es común emplear interferometría para determinar el espectro; la espectroscopia infrarroja por transformada de Fourier es una implementación ampliamente utilizada de esta técnica.
Otros dos aspectos que deben tenerse en cuenta al preparar un experimento de espectroscopia de absorción son la óptica utilizada para dirigir la radiación y los medios para sujetar o contener el material de muestra (denominados cubetas o celdas). Para la mayoría de las mediciones de rayos UV, visibles y de infrarrojo cercano, es necesario utilizar cubetas de cuarzo de precisión. En ambos casos, es importante seleccionar materiales que tengan relativamente poca absorción propia en el rango de longitud de onda de interés. La absorción de otros materiales podría interferir con la absorción de la muestra o enmascararla. Por ejemplo, en varios rangos de longitud de onda es necesario medir la muestra al vacío o en un entorno de gas noble porque los gases de la atmósfera tienen características de absorción que interfieren.