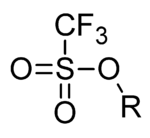

En química orgánica , el triflato ( nombre sistemático : trifluorometanosulfonato ) es un grupo funcional con la fórmula R− OSO2CF3 y estructura R−O−S(=O) 2 − CF3 . El grupo triflato se representa a menudo por −OTf , a diferencia de −Tf , que es el grupo triflilo , R − SO2CF3 . Por ejemplo, el triflato de n -butilo se puede escribir como CH3CH2CH2CH2OTf .
El anión triflato correspondiente , CF 3 SO−3, es un ion poliatómico extremadamente estable ; esto se debe a que el ácido tríflico ( CF 3 SO 3 H ) es un superácido ; es decir, es más ácido que el ácido sulfúrico puro , uno de los ácidos más fuertes conocidos.
Un grupo triflato es un excelente grupo saliente utilizado en ciertas reacciones orgánicas como la sustitución nucleofílica , los acoplamientos de Suzuki y las reacciones de Heck . Dado que los triflatos de alquilo son extremadamente reactivos en las reacciones S N 2 , deben almacenarse en condiciones libres de nucleófilos (como el agua ). El anión debe su estabilidad a la estabilización por resonancia que hace que la carga negativa se distribuya simétricamente sobre los tres átomos de oxígeno. El grupo trifluorometilo consigue una estabilización adicional , que actúa como un fuerte grupo atractor de electrones utilizando el átomo de azufre como puente.
Los triflatos también se han aplicado como ligandos para metales del grupo 11 y 13 junto con los lantánidos .
Los triflatos de litio se utilizan en algunas baterías de iones de litio como componente del electrolito .
Un reactivo triflante suave es la triflimida de fenilo o N , N - bis(trifluorometanosulfonil)anilina , donde el subproducto es [CF3SO2N − Ph ] − .
Las sales de triflato son muy estables térmicamente, con puntos de fusión de hasta 350 °C para las sales de sodio , boro y plata , especialmente en forma libre de agua. Se pueden obtener directamente a partir del ácido tríflico y el hidróxido metálico o el carbonato metálico en agua. Alternativamente, se pueden obtener a partir de la reacción de cloruros metálicos con ácido tríflico puro o triflato de plata , o a partir de la reacción de triflato de bario con sulfatos metálicos en agua: [1]
Los triflatos metálicos se utilizan como catalizadores de ácidos de Lewis en química orgánica . Especialmente útiles son los triflatos de lantánidos del tipo Ln(OTf) 3 (donde Ln es un lantanoide ). Un catalizador popular relacionado, el triflato de escandio, se utiliza en reacciones como las reacciones aldólicas y las reacciones de Diels-Alder . Un ejemplo es la reacción de adición aldólica de Mukaiyama entre el benzaldehído y el éter enólico de sililo de ciclohexanona con un rendimiento químico del 81% . [2] La reacción correspondiente con la sal de itrio falla:

El triflato es un anión de coordinación débil de uso común .
